В работе на опыте исследуются статистические закономерности, которые наблюдаются в целом ряде явлений, в том числе во многих явлениях микромира. В области молекулярных явлений, например, им подчиняется распределение молекул идеального газа по скоростям и энергиям, если газ находится в равновесном состоянии.
Для этого типа закономерностей характерны два момента: во-первых, наличие большого, но конечного числа однородных объектов; во-вторых, то, что значение скорости молекулы газа не может быть определено однозначно: оно зависит от большого числа необходимых и случайных факторов. Однако, хотя значение скорости отдельной молекулы случайная величина, для большого числа молекул существует определенный закон их распределения по скоростям: скоростью в каждом возможном интервале значений обладает совершенно определенное число молекул при данной температуре.
В статистической теории существует понятие функции распределения,
с помощью которой можно рассчитать число молекул ![]() из общего
числа их
из общего
числа их ![]() , имеющих относительную скорость в некотором
бесконечно малом интервале скоростей
, имеющих относительную скорость в некотором
бесконечно малом интервале скоростей ![]() :
:
Наиболее общие количественные стороны статистических
закономерностей изучаются теорией вероятности. Отношение ![]() в этой теории называется вероятностью случайного
события, а
в этой теории называется вероятностью случайного
события, а ![]() плотностью
вероятности. Отношение
плотностью
вероятности. Отношение ![]() одновременно является
относительным числом молекул, имеющих значения относительной
скорости в бесконечно малом интервале значений
одновременно является
относительным числом молекул, имеющих значения относительной
скорости в бесконечно малом интервале значений ![]() и вероятностью
того, что некоторая молекула имеет значение относительной скорости
в интервале
и вероятностью
того, что некоторая молекула имеет значение относительной скорости
в интервале ![]() . Это отношение рассчитывается так:
. Это отношение рассчитывается так:
Функция распределения молекул газа по скоростям была найдена
английским физиком Д.Максвеллом и носит его имя. Для
относительных значений скорости она не зависит от рода газа и его
температуры и имеет вид:
На рис.3.1 представлен график распределения Максвелла для
относительных значений скорости (1). По оси абсцисс
отложены возможные значения скорости ![]() , а по оси ординат --
соответствующие им значения
, а по оси ординат --
соответствующие им значения ![]() . Максимум функции
соответствует наиболее вероятной скорости молекул, при этом
. Максимум функции
соответствует наиболее вероятной скорости молекул, при этом ![]() .
Число молекул с нулевой скоростью равно нулю; малое число молекул
имеет и очень большие скорости по сравнению с наиболее вероятной.
Наибольшее число молекул имеет скорости, близкие к наиболее
вероятной. График несимметричен относительно максимума, значит,
число молекул со скоростями, большими наиболее вероятной,
превосходит число их со скоростями, меньшими наиболее вероятной.
.
Число молекул с нулевой скоростью равно нулю; малое число молекул
имеет и очень большие скорости по сравнению с наиболее вероятной.
Наибольшее число молекул имеет скорости, близкие к наиболее
вероятной. График несимметричен относительно максимума, значит,
число молекул со скоростями, большими наиболее вероятной,
превосходит число их со скоростями, меньшими наиболее вероятной.
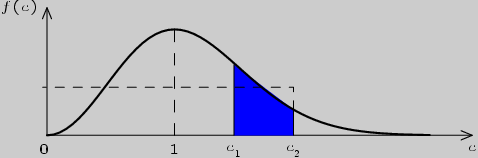
Рис. 3.1
Число молекул ![]() со скоростями в некотором конечном
интервале значений
со скоростями в некотором конечном
интервале значений
![]() (отношение
(отношение
![]() численно равно площади фигуры, заштрихованной на
рис.3.1.) находится интегрированием:
численно равно площади фигуры, заштрихованной на
рис.3.1.) находится интегрированием:
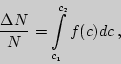
Площадь фигуры, ограниченной кривой и осью абсцисс, равна единице.
Действительно интеграл:
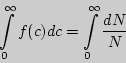
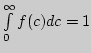 , что
справедливо для всякой функции распределения и называется условием
нормировки.
, что
справедливо для всякой функции распределения и называется условием
нормировки.
В данной работе для изучения особенностей статистических закономерностей
используется нормальное распределение
(Гаусса). Такой вид имеет распределение молекул идеального газа по
составляющим скоростей ![]() ,
, ![]() ,
, ![]() . Оно моделируется на
доске Гальтона -- механической модели, воспроизводящей картину
случайных отклонений от среднего расположения сыпучего вещества на
ней.
. Оно моделируется на
доске Гальтона -- механической модели, воспроизводящей картину
случайных отклонений от среднего расположения сыпучего вещества на
ней.
Нормальное распределение в общем случае имеет вид:
Функция, имеет максимум при ![]() . Это значение функции называется
наиболее вероятным.
. Это значение функции называется
наиболее вероятным.
Нормальное распределение имеет место в тех случаях, когда случайная величина зависит от большого числа факторов, которые могут вносить с равной вероятностью положительные и отрицательные отклонения от среднего (наиболее вероятного) значения величины. Примером такого распределения является распределение случайных ошибок измерений при измерениях.
Рассмотрим влияние параметра ![]() на форму графика. На рисунке
3.2 показан вид таких графиков для
на форму графика. На рисунке
3.2 показан вид таких графиков для ![]() при различных
при различных
![]() .
.
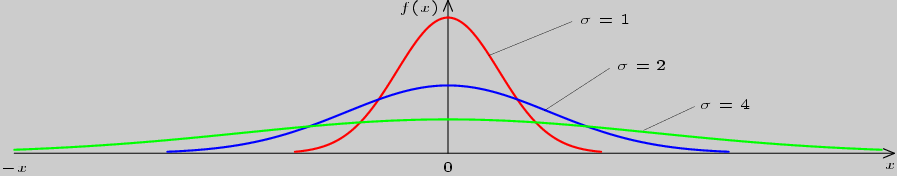
Рис. 3.2
Как видно, чем меньше ![]() , тем больший максимум имеет кривая,
тем круче она идет. Это означает, что вероятность попадания
в некоторый интервал больше для той
случайной величины, распределенной по нормальному закону (с
параметром
, тем больший максимум имеет кривая,
тем круче она идет. Это означает, что вероятность попадания
в некоторый интервал больше для той
случайной величины, распределенной по нормальному закону (с
параметром ![]() ), для которой величина
), для которой величина ![]() меньше.
Следовательно,
меньше.
Следовательно, ![]() можно считать характеристикой разброса
случайной величины
можно считать характеристикой разброса
случайной величины ![]() .
.
Если ![]() кривая сдвигается вправо или влево в зависимости от
знака
кривая сдвигается вправо или влево в зависимости от
знака ![]() .
.
Площадь, ограниченная любой из этих кривых, остается равной единице.
В данной работе нужно на опыте определить
![]() и получить конкретный вид функции
распределения
и получить конкретный вид функции
распределения
![]() .
.
Сходные изменения хода графика существуют и для функции распределения Максвелла молекул идеального газа по абсолютным значениям скоростей при изменении абсолютной температуры или рода газа, принимаемого за идеальный. Распределение Максвелла в этом случае имеет вид: