Экспериментальный метод можно пояснить с помощью установки, состоящей из стеклянного сосуда большой емкости (рис.3.1), соединенного с манометром, который может соединяться с атмосферой или с насосом. Разность между давлением воздуха в сосуде и атмосферным давлением измеряется открытым жидкостным манометром, одно колено которого соединено с сосудом.
Обозначим атмосферное давление во время опыта ![]() , абсолютную
температуру воздуха в комнате
, абсолютную
температуру воздуха в комнате ![]() , объем газа
, объем газа ![]() , а массу
газа в сосуде
, а массу
газа в сосуде ![]() . Если, разобщив баллон с атмосферой, накачать в
него насосом небольшое количество воздуха, давление в сосуде
повысится.
. Если, разобщив баллон с атмосферой, накачать в
него насосом небольшое количество воздуха, давление в сосуде
повысится.
При любой массе газа он занимает в сосуде весь объем ![]() . При
накачивании или выпускании воздуха масса его в сосуде меняется, и
уравнения изопроцессов становятся непригодными. Но они сохраняет
свой вид, если рассматривать удельный объем
. При
накачивании или выпускании воздуха масса его в сосуде меняется, и
уравнения изопроцессов становятся непригодными. Но они сохраняет
свой вид, если рассматривать удельный объем ![]() . Объем
сосуда остается неизменным, поэтому увеличение массы газа в сосуде
приводит к уменьшению удельного объема газа.
. Объем
сосуда остается неизменным, поэтому увеличение массы газа в сосуде
приводит к уменьшению удельного объема газа.
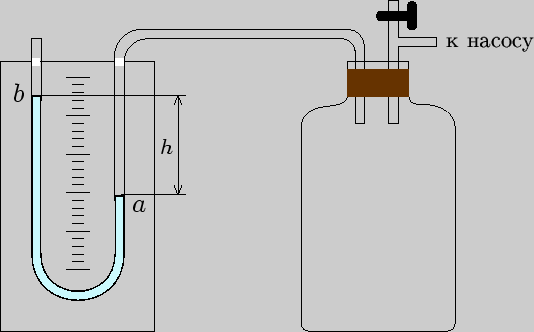
Рис. 3.1
При помощи насоса в сосуд накачивается некоторое количество газа
массы ![]() , занимающего некоторый объем
, занимающего некоторый объем ![]() . Его удельный объем
. Его удельный объем
![]() .
.
При накачивании газа совершается работа внешними силами. Если
накачивать газ быстро, то теплообменом газа с окружающей средой
через стенки можно пренебречь и считать процесс адиабатическим. За
счет работы внешних сил увеличится внутренняя энергия газа, он
нагреется до температуры ![]() , а давление его станет равным
, а давление его станет равным
![]() . Установится первое состояние газа. Процесс накачивания
изображен на рис.3.2 кривой
. Установится первое состояние газа. Процесс накачивания
изображен на рис.3.2 кривой ![]() . На оси абсцисс указаны
удельные объемы.
. На оси абсцисс указаны
удельные объемы.
После прекращения накачивания неизменная масса ![]() , изохорически
охлаждается до комнатной температуры
, изохорически
охлаждается до комнатной температуры ![]() зa счет теплообмена.
Из-за малой теплопроводности стекла это продолжается
зa счет теплообмена.
Из-за малой теплопроводности стекла это продолжается ![]() минуты.
Изохорический процесс на рис.3.2 изображен прямой
минуты.
Изохорический процесс на рис.3.2 изображен прямой ![]() .
В конце изохорического процесса устанавливается второе
состояние газа с давлением
.
В конце изохорического процесса устанавливается второе
состояние газа с давлением
![]() , температурой
, температурой
![]() и удельным объемом
и удельным объемом
![]() .
.
Здесь ![]() -- избыточное над атмосферным давление газа,
измеряемое манометром во втором состоянии, то есть после накачивания
и установления равновесного состояния газа в сосуде.
-- избыточное над атмосферным давление газа,
измеряемое манометром во втором состоянии, то есть после накачивания
и установления равновесного состояния газа в сосуде.
Если теперь на короткое время открыть кран, часть газа выйдет из
сосуда, давление его станет равным атмосферному, а температура газа
в сосуде понизится. Этот процесс можно считать адиабатическим
вследствие быстроты (![]() ). Состояние газа при открытом кране
является третьим состоянием и характеризуется параметрам
). Состояние газа при открытом кране
является третьим состоянием и характеризуется параметрам
![]() (
(![]() -- масса газа, оставшегося в сосуде),
-- масса газа, оставшегося в сосуде),
![]() ,
, ![]() , причем
, причем ![]() , а
, а ![]() .
.
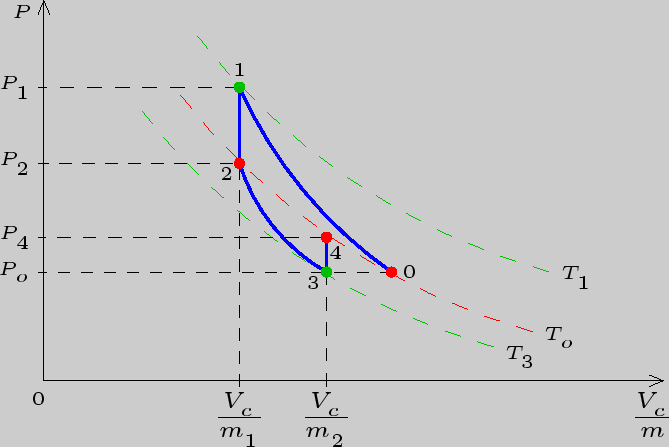
Рис. 3.2
После этого в течение ![]() минут происходит нагревание газа в
сосуде за счет теплообмена, пока температура не сравняется с
комнатной; давление газа при этом возрастает. Новое установившееся
состояние является четвертым и описывается параметрами
минут происходит нагревание газа в
сосуде за счет теплообмена, пока температура не сравняется с
комнатной; давление газа при этом возрастает. Новое установившееся
состояние является четвертым и описывается параметрами
![]() ,
, ![]() ,
, ![]() . При этом
. При этом
![]() .
Здесь
.
Здесь ![]() -- избыточное над внешним давление, измеряемое после того, как кран
закрыт и снова наступило равновесное состояние газа. Графики
описанных процессов изображены на рис.3.2. Пунктирные
кривые
-- изотермы.
-- избыточное над внешним давление, измеряемое после того, как кран
закрыт и снова наступило равновесное состояние газа. Графики
описанных процессов изображены на рис.3.2. Пунктирные
кривые
-- изотермы.
Для вывода расчетной формулы рассмотрим часть графика, а именно
участки ![]() и
и ![]() и учтем, что точки 2 и 4 лежат на одной
изотерме. Переход из второго состояния в третье происходит
адиабатически, для него справедливо уравнение Пуассона:
и учтем, что точки 2 и 4 лежат на одной
изотерме. Переход из второго состояния в третье происходит
адиабатически, для него справедливо уравнение Пуассона:
При ![]() и
и
![]() , получаем
, получаем
Процесс на участке ![]() изохорический, а точки 2 и 4 лежат на одной
изотерме, поэтому можно применить уравнение Бойля - Мариотта для
удельных объемов:
изохорический, а точки 2 и 4 лежат на одной
изотерме, поэтому можно применить уравнение Бойля - Мариотта для
удельных объемов:
Отсюда
Если ![]() мало по сравнению с
мало по сравнению с
![]() , то
, то
Используя это соотношение, получим:
Величина избыточного давления измеряется разностью уровней жидкости
в манометре (см. рис.3.1): ![]() .
.
Здесь ![]() -- плотность жидкости в манометре.
-- плотность жидкости в манометре.
При
![]()
Полученное соотношение является расчетной формулой для ![]() в
данной работе. Таким образом для нахождения искомой величины следует
измерить
в
данной работе. Таким образом для нахождения искомой величины следует
измерить ![]() и
и ![]() .
.