Пример 7.3. Сжиженные газы хранят в сосудах, сообщающихся с атмосферой. Можно ли допустить испарение жидкого азота объемом $\displaystyle{0,5\,{\text{л}}}$ и плотностью $\displaystyle{0,81\,{\text{г/см}}^3}$ в закрытом сосуде объемом $\displaystyle{10\,{\text{л}}}$ при нагревании его до температуры $\displaystyle{20^\circ C}$ , если стенки сосуда выдерживают давление $\displaystyle{20\,{\text{атм}}}$ ?
Дано:
| |||||
| $\displaystyle{P_x}$ – ? |
Решение. При повышении температуры жидкий азот перейдет в газообразное состояние. Примем его при температуре $\displaystyle{20^\circ C}$ за идеальный газ и применим для решения уравнение Клапейрона – Менделеева:
где $\displaystyle{P}$ , $\displaystyle{V}$ и $\displaystyle{T}$ – давление, объем и температура газа; $\displaystyle{m}$ – его масса, $\displaystyle{\mu}$ – масса моля азота, равная $\displaystyle{28\cdot 10^{-3}\,{\text{кг/моль}}}$ ; $\displaystyle{R}$ – универсальная газовая постоянная.
Для ответа на вопрос задачи нужно определить давление газообразного азота и сравнить его с максимально допустимым.
Выразим искомое давление из уравнения (26):
здесь неизвестна масса газа, ее можно определить через объем и плотность жидкого азота: $\displaystyle{m= \rho_1V_1}$ . Выражение для искомого давления в общем виде:
Проверка наименования единицы искомой величины:
| (29) |
Это единица давления в СИ, следовательно, выражение в общем виде получено правильно.
Вычисления: подставим числа (все они должны быть выражены в СИ):
| (30) |
Прежде чем вычислять, проведем действия со степенями:
| (31) |
Искомое давление равно $\displaystyle{3,52\cdot 10^6\,{\text{Па}}}$ или $\displaystyle{35,2\ {\text{атм}}}$ и превышает допустимое.
Ответ: испарение жидкого азота данной массы в закрытом сосуде указанного объема нельзя допустить, так как при $\displaystyle{20^\circ \,С}$ давление превысит допустимое. Поэтому сжиженные газы хранят в открытых сосудах.
Пример 7.4. Расстояние между стенками сосуда равно $\displaystyle{ 8 \,{\text{мм}} }$ . При каком давлении вязкость газа, находящегося между ними, начнет уменьшаться при откачке? Температура газа равна $\displaystyle{17^\circ C}$ . Диаметр молекулы составляет $\displaystyle{3\cdot 10^{-10}\,{\text{м}}}$ .
Дано:
| |||
| $\displaystyle{P}$ - ? |
Решение. Теоретически вязкость газа при не слишком низких давлениях не зависит от него:
| (33) |
а плотность газа $\displaystyle{\rho}$ прямо пропорциональна давлению. Выражение для плотности идеального газа можно получить из уравнения Клапейрона – Менделеева: $\displaystyle{PV = {m\over\mu}RT}$ , учитывая, что плотность – это масса единицы объема: $\displaystyle{\rho = {m\over V}}$ . Получается, что $\displaystyle{\rho = {\mu P\over RT}}$ .
При низком давлении средняя длина свободного пробега перестает зависеть от давления и определяется размерами сосуда:
Молекулы движутся от стенки к стенке, не сталкиваясь между собой. Вязкость газа начнет уменьшаться при дальнейшей откачке сосуда за счет уменьшения концентрации молекул (плотности газа).
Для решения задачи нужно приравнять выражение для средней длины свободного пробeгa молекул $\displaystyle{\overline{\lambda}}$ расстоянию между стенками сосуда:
| (35) |
В этом выражении для давления все известно.
Проверка наименования единицы измерения:
| (37) |
Выражение для давления в общем виде получено правильно.
Вычисления:
| (38) |
Полученное число значительно меньше величины атмосферного давления. Для данного газа при неизменной температуре оно определяется только размерами сосуда $\displaystyle{\ell}$ .
Ответ: при давлении 1,26 Па вязкость газа начнет уменьшаться при откачке. Указание: подобным образом решаются задачи, связанные с коэффициентом теплопроводности идеального газа:
| (39) |
| (40) |
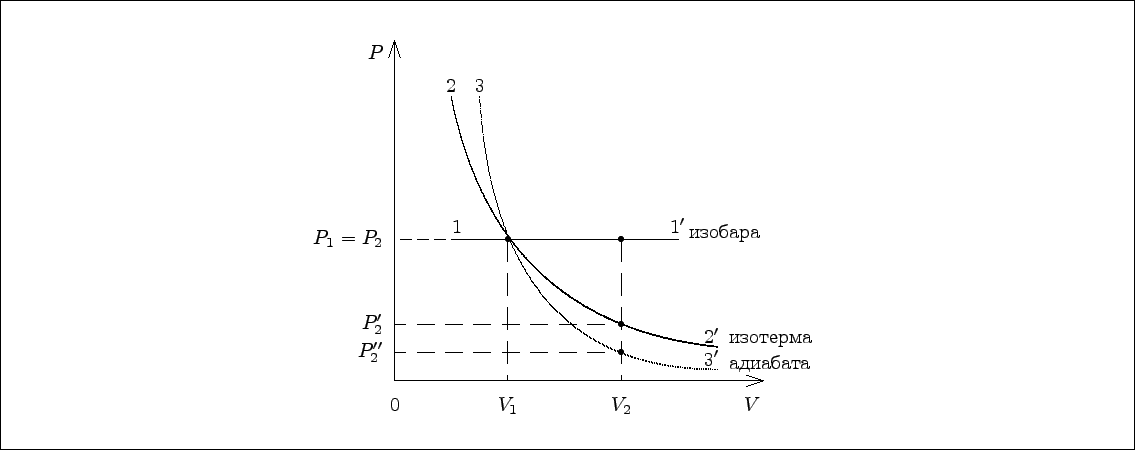
Пример 7.5. 10 л азота, находящегося под давлением $\displaystyle{10^5\,{\text{Па}}}$ , расширяются вдвое. Найти конечное давление и совершенную газом работу в случаях изобарического, изотермического и адиабатического процессов. Молекулы азота имеют пять степеней свободы.
Дано:
| ||||
| $\displaystyle{P_2}$ - ? $\displaystyle{A}$ - ? |
Решение. Примем азот в данных условиях за идеальный газ.
1. При изобарическом процессе давление газа не меняется, поэтому $\displaystyle{P_2=P_1}$ . Элементарная работа расширения равна в общем случае $\displaystyle{PdV}$ , где $\displaystyle{P}$ – давление, $\displaystyle{dV}$ – бесконечно малый объем. Полная работа находится путем интегрирования, и величина eе зависит от вида процесса.
При изобарическом процессе
Проверим единицу измерения работы:
| (42) |
2. В изотермическом процессе температура остается постоянной, а давления и объемы в двух состояниях идеального газа связаны законом Бойля – Мариотта: $\displaystyle{P_1V_1=P_2V_2}$ , откуда $\displaystyle{P_2'={P_1V_1\over V_2}}$ . Видно, что здесь для единицы неизвестного давления получается Па (паскаль).
Работа изотермического расширения рассчитывается так:
| (43) |
Здесь давление выражено из уравнения Клапейрона – Менделеева. Температура неизвестна, поэтому, применив еще раз уравнение Клапейрона – Менделеева, получим выражение для искомой работы через известные в условии величины:
Результат не изменится, если подставить конечные давление и объем $\displaystyle{P_2}$ и $\displaystyle{V_2}$ или вместо отношения $\displaystyle{{V_2\over V_1}}$ взять $\displaystyle{{P_1\over P_2}}$ .
3. Конечное давление адиабатического расширения выразим из уравнения Пуассона:
| (45) |
( $\displaystyle{i}$ - число степеней свободы молекулы).
Работа в этом процессе совершается за счет убыли внутренней энергии газа:
| (46) |
| (47) |

Рис. 7.1
В этой задаче температуры не заданы, поэтому отношение температур следует заменить отношением объемов $\displaystyle{{T_2\over T_1}=\left({V_1\over V_2}\right)^{\gamma-1}}$ и воспользоваться уравнением состояния идеального газа:| (48) |
Здесь все известно, конечное давление можно рассчитать отдельно.
Вычисления:
$\displaystyle{A_2=10^{5}\cdot 10^{-2}\ln{2\cdot 10^{-2}\over 10^{-2}}\,{\text{Дж}}=10^{3}\ln{2}\,{\text{Дж}}= 6,9\cdot 10^2\,{\text{Дж}}}$ .
Таким образом, наибольшее изменение давления происходит при адиабатическом расширении, а наибольшая работа совершается при изобарическом. Качественно результаты представлены на рисунке. Площади фигур под графиками процессов позволяют судить о соотношении совершенной работы.
Ответ: $\displaystyle{10^{5}\,{\text{Па}}\,,\ 10^{3}\,{\text{Дж}}\,;\ 5\cdot 10^{4}\,{\text{Па}}\,,\ 690\,{\text{Дж}}\,;\ 3,8\cdot 10^4\,{\text{Па}}\,,\ 600\,{\text{Дж}}}$ .
ЯГПУ, Отдел образовательных информационных технологий 10.07.2012