Атомом называется наименьшая частица химического элемента,
обладающая его химическими свойствами. Атом (![]() см)
состоит из положительного ядра (
см)
состоит из положительного ядра (![]() см) и электронов,
движущихся в кулоновском поле. Заряд ядра равен суммарному заряду
его электронов. Простейшим атомом является атом водорода. Атом
водорода имеет протон (ядро), вокруг которого движется один
электрон. Водородоподобными атомами являются ионы
см) и электронов,
движущихся в кулоновском поле. Заряд ядра равен суммарному заряду
его электронов. Простейшим атомом является атом водорода. Атом
водорода имеет протон (ядро), вокруг которого движется один
электрон. Водородоподобными атомами являются ионы ![]() ,
, ![]() ,
,
![]() и т.д.
и т.д.
В основу теории атома водорода положены два постулата Бора. Первый постулат. Электроны могут двигаться только по определенным орбитам, находясь на которых, они, несмотря на наличие у них ускорения, не излучают. Эти орбиты соответствуют условиям:

Уравнение (23) называют также условием квантования.
Второй постулат. Атом излучает (поглощает) квант электромагнитной энергии, когда электрон переходит с орбиты с большим (меньшим) радиусом на орбиту с меньшим (большим) радиусом. Энергия кванта равна разности энергий электрона на орбитах до и после перехода.
В стационарном состоянии с ![]() (основное состояние) атомы могут
находиться сколь угодно долго. Если электрон в атоме, находящемся в
основном состоянии, получил извне энергию и перешел на другую орбиту
с
(основное состояние) атомы могут
находиться сколь угодно долго. Если электрон в атоме, находящемся в
основном состоянии, получил извне энергию и перешел на другую орбиту
с ![]() , то атом перешел в возбужденное состояние. В возбужденном
состоянии атом имеет большую энергию, чем в основном. Возбужденное
состояние неустойчиво, через
, то атом перешел в возбужденное состояние. В возбужденном
состоянии атом имеет большую энергию, чем в основном. Возбужденное
состояние неустойчиво, через ![]() электрон скачком
(мгновенно) переходит в стационарное состояние с меньшей энергией.
Излишек энергии излучается в пространство в виде монохроматического
излучения, то есть какой-то одной спектральной линии.
электрон скачком
(мгновенно) переходит в стационарное состояние с меньшей энергией.
Излишек энергии излучается в пространство в виде монохроматического
излучения, то есть какой-то одной спектральной линии.
Частота излучения атома подчиняется условию:
Для каждого перехода электрона излучается своя спектральная линия, таким образом, спектр такого излучения представляет собой отдельные линии.
Постулаты Бора не следуют ни из каких положений классической физики, они
получают объяснение на основе квантовой теории. Из постулатов Бора вытекает
наличие в атоме уровней энергии ![]() ,
, ![]() ,
, ![]() , ...,
, ..., ![]() . Эти
значения соответствуют различным возбужденным состояниям атома. Испускание или
поглощение кванта энергии сопровождается переходом атома из одного состояния
в другое. Наличие в атоме дискретных уровней энергии подтверждают опыты
Франка и Герца.
. Эти
значения соответствуют различным возбужденным состояниям атома. Испускание или
поглощение кванта энергии сопровождается переходом атома из одного состояния
в другое. Наличие в атоме дискретных уровней энергии подтверждают опыты
Франка и Герца.
Непосредственные экспериментальные доказательства существования дискретных уровней энергии в атоме были получены при определении потенциалов возбуждения и ионизации атомов газа. Для того, чтобы атом мог излучать энергию, необходимо перевести его в возбужденное состояние, то есть переместить электрон в атоме с основной орбиты на одну из внешних орбит, этот процесс называется возбуждением атома. Возбуждение может быть вызвано различными способами: нагреванием до высоких температур, неупругим столкновением атомов с быстрым свободным электроном и др.
Разберем случай прохождения свободного электрона через газ. Столкновения электронов с атомами могут происходить двумя способами. В одном случае электрон может передать часть своей энергии атому, при этом потенциальная энергия атома не изменится. Такие столкновения называют упругими. Столкновения другого рода ведут либо к ионизации, либо к возбуждению атома, то есть электрон, столкнувшись с атомом, передает электрону атома такое количество кинетической энергии, что он может либо оторваться от атома, либо перейти на более высокий уровень. Такие столкновения называются неупругими. Часть кинетической энергии при этом преобразуется в потенциальную.
Напишем законы сохранения энергии и импульса при упругом соударении:

Разность энергии электрона до и после соударения обозначим:
Относительная убыль энергии электрона:
Если
![]() , то
, то
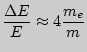 .
.
Подсчитаем относительную убыль энергии электрона при неупругом соударении:
где ![]() - совместная скорость электрона и атома после удара.
Отсюда следует:
- совместная скорость электрона и атома после удара.
Отсюда следует:
Сравнивая относительную убыль энергии при упругом и неупругом ударе, замечаем:
Таким образом, если электроны взаимодействуют с атомами по закону упругого удара, то энергия электронов практически не будет изменяться. При неупругом ударе почти вся энергия электронов переходит атомам. Это дает возможность различать такие столкновения экспериментально.
В данной работе находят второй и первый потенциалы возбуждения для атомов гелия или неона, другими словами, определяют, при какой наименьшей энергии происходят первое и второе неупругие столкновения атома с быстро летящим электроном.