| (3) |
Первое начало термодинамики обычно формулируется в виде утверждения:
При переходе из состояния 1 в состояние 2 поглощенное
телом тепло расходуется на совершение механической
работы и увеличение внутренней энергии системы:
Все входящие в данное соотношение величины могут принимать
положительные и отрицательные значения: тепло ![]() положительно,
если оно поглощается системой, и отрицательно, если оно отдается;
работа
положительно,
если оно поглощается системой, и отрицательно, если оно отдается;
работа ![]() положительна, если она совершается системой над
внешними телами, и отрицательна, если работа совершается над
системой; изменение внутренней энергии положительно, если
поглощенное тепло больше, чем совершенная работа, если же тепла
поглощается меньше, чем производится работы (например, при
адиабатическом расширении), то внутренняя энергия системы
уменьшается:
положительна, если она совершается системой над
внешними телами, и отрицательна, если работа совершается над
системой; изменение внутренней энергии положительно, если
поглощенное тепло больше, чем совершенная работа, если же тепла
поглощается меньше, чем производится работы (например, при
адиабатическом расширении), то внутренняя энергия системы
уменьшается:
![]() .
.
Проанализируем смысл сделанного утверждения.
Во-первых,
оно означает введение новой величины - внутренней
энергии системы, которая может увеличиваться или
уменьшаться в
зависимости от соотношения поглощенного тепла и произведенной
работы.
Во-вторых, в нем содержится так называемый принцип эквивалентности тепла и механической работы. Этот принцип заключается в том, что тепло и работа являются различными формами энергообмена системы с окружающей средой. Одно и то же изменение внутренней энергии системы может быть достигнуто за счет совершения работы без поглощения или выделения тепла (в адиабатическом процессе) либо за счет теплообмена без совершения работы (в изохорном процессе). В результате поглощения тепла система может совершать полезную работу, и наоборот - внешняя работа при определенных условиях может приводить к выделению системой тепла. Эквивалентность тепла и работы с сегодняшних позиций представляется очевидной. Действительно, нагревание тел в результате трения было известно с первобытных времен. Однако ясное научное понимание взаимосвязи тепловых и механических явлений было достигнуто лишь к середине прошлого столетия.
В-третьих, первое начало термодинамики представляет собой обобщенный закон сохранения энергии, который утверждает, что во всех процессах перехода энергии из тепловой формы в механическую и наоборот разница между поглощенным теплом и произведенной работой в точности покрывается изменением внутренней энергии системы.
Первое начало термодинамики впервые было сформулировано в работе Р. Майера (1841 г.), которая, однако, стала известной лишь после появления работ Джоуля, Клаузиуса и Гельмгольца. Наиболее значительный вклад в экспериментальную проверку первого начала внес Д. Джоуль, который с поразительной для того времени точностью определил механический эквивалент тепла, то есть установил соотношение между единицами измерения тепла и работы. Используемая в настоящее время так называемая международная калория содержит 4,1868 Дж.
Приведенная выше формулировка первого начала термодинамики не является полной. Для того, чтобы сделать к ней необходимое дополнение, рассмотрим следующую задачу.
Идеальный газ переходит из состояния 1 в состояние 2 (давление
![]() , объем
, объем ![]() ) двумя способами: в первом способе
вначале происходит расширение газа при постоянном давлении, а
затем - уменьшение давления при постоянном объеме; во втором
способе, наоборот, сначала уменьшается давление при постоянном
объеме, а затем происходит изобарное расширение (рис. 3). Найти
поглощенное тепло, совершенную работу и изменение внутренней
энергии в каждом из способов.
) двумя способами: в первом способе
вначале происходит расширение газа при постоянном давлении, а
затем - уменьшение давления при постоянном объеме; во втором
способе, наоборот, сначала уменьшается давление при постоянном
объеме, а затем происходит изобарное расширение (рис. 3). Найти
поглощенное тепло, совершенную работу и изменение внутренней
энергии в каждом из способов.
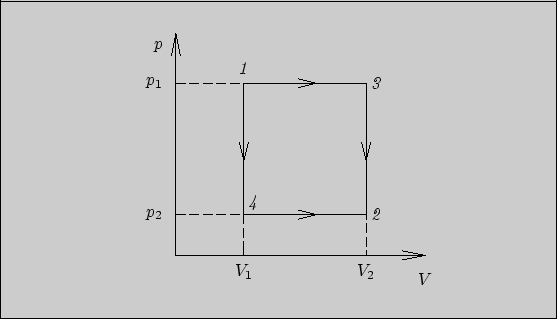
Рис. 3
Решение. Из рисунка видно, что впервом способе переход системы из состояния 1 в состояние 2
осуществляется через промежуточное состояние 3, во втором способе - через
состояние 4. Работа в первом способе равна
При вычислении поглощенного тепла будем
для простоты считать, что количество газа - один моль.
Тогда в первом способе поглощенное тепло составляет
Из рассмотренной задачи можно сделать два вывода.
В молекулярной физике второй вывод легко обобщить на любые системы и любые процессы. Действительно, если представлять внутреннюю энергию как среднее значение полной механической энергии всех частиц системы, то ясно, что это значение не должно зависеть от способа перехода системы в данное термодинамическое состояние.
В аксиоматической термодинамике обобщение второго вывода из нашей задачи на случай произвольной системы и произвольных процессов имеет характер постулата, который и является необходимым дополнением формулировки первого начала термодинамики, данной в начале параграфа. С учетом этого первое начало можно сформулировать следующим образом.
Термодинамическому состоянию системы соответствует
определенное значение ее внутренней
энергии, которое
может увеличиваться при поглощении системой тепла
либо при совершении над ней работы:
Обратим внимание, что данная формулировка определяет не само
значение внутренней энергии, а ее изменение при переходе из
состояния 1 в состояние 2. Таким образом, сама внутренняя энергия
системы ![]() определяется с точностью до произвольного постоянного
слагаемого.
определяется с точностью до произвольного постоянного
слагаемого.
Величины, значение которых определяется термодинамическим состоянием системы и не зависит от способа перехода системы в это состояние, называются функциями или параметрами состояния. К параметрам состояния относятся температура, давление, объем, масса, плотность системы.
Выше говорилось, что тепло, поглощенное однородной системой,
делится между ее частями в отношении их масс (в состоянии
равновесия). Иными словами, поглощенное системой тепло
складывается из порций тепла, поглощенного частями системы (при
такой формулировке однородности системы и равновесия между ее частями
не требуется). Аналогичным свойством обладает работа системы. Это
можно пояснить следующим образом. Мысленно разобьем столб газа
под поршнем (см. рис. 1) вертикальной стенкой на две части.
К каждой из этих частей будет относиться все сказанное о целом столбе.
Тогда
Из этих рассуждений с учетом первого начала термодинамики вытекает свойство аддитивности внутренней энергии системы: внутренняя энергия системы складывается из внутренних энергий ее частей (подсистем).
Свойство аддитивности внутренней энергии позволяет обобщить первое начало термодинамики на задачи, в которых учитывается обмен веществом между системами. Для этого нужно порции вещества, участвующие в обмене, представлять как отдельные части системы и применять к ним первое начало термодинамики как к системам.
3.1. Может ли теплоемкость газа при постоянном объеме превышать его теплоемкость при постоянном давлении?
3.2.
Температура идеального газа изменяется от значения ![]() до
значения
до
значения ![]() . На сколько при этом изменяется его внутренняя
энергия?
. На сколько при этом изменяется его внутренняя
энергия?
3.3.
Газ расширяется от объема ![]() до объема
до объема ![]() : а) изотермически;
б) адиабатически. В каком из этих случаев при одинаковом
начальном давлении конечное давление будет больше? Почему?
: а) изотермически;
б) адиабатически. В каком из этих случаев при одинаковом
начальном давлении конечное давление будет больше? Почему?
3.4. Может ли газ при нагревании (повышении температуры) выделять тепло?
3.5.
Идеальный газ адиабатически расширяется из состояния 1
![]() в состояние 2
в состояние 2
![]() . После этого
газу при постоянном объеме передается тепло в количестве,
эквивалентном совершенной работе. Чему равна конечная температура
газа?
. После этого
газу при постоянном объеме передается тепло в количестве,
эквивалентном совершенной работе. Чему равна конечная температура
газа?
3.6. Внутри сосуда, заполненного идеальным газом, имеется пустая полость. Открытием крана газу дают возможность заполнить полость. Что происходит при этом с температурой газа?
3.7.
Доказать соотношение Майера для молярных теплоемкостей идеального
газа:
3.8. Вычислить механический
эквивалент тепла (отношение калории к джоулю), пользуясь следующими данными
для
воздуха: при температуре ![]() и атмосферном
давлении
и атмосферном
давлении
![]() плотность составляет
плотность составляет
![]() , удельная теплоемкость при постоянном давлении
, удельная теплоемкость при постоянном давлении
![]()
![]() , ее отношение к удельной
теплоемкости при постоянном объеме
, ее отношение к удельной
теплоемкости при постоянном объеме
![]() . Воздух считать идеальным
газом.
. Воздух считать идеальным
газом.
3.9.
Найти изменение внутренней энергии при испарении 20 г этанола в
точке кипения при атмосферном давлении, если известно, что его
удельная теплота парообразования при этой температуре равна
205 ккал/кг, удельный объем пара 0,607
![]() , удельным объемом
жидкости можно пренебречь.
, удельным объемом
жидкости можно пренебречь.
![\begin{picture}(67.00,58.00)
\emline{12.00}{9.00}{1}{12.00}{58.00}{2}
\emline{11...
...ox(0,0)[rt]{$p_{1}$}}
\put(9.00,23.00){\makebox(0,0)[rc]{$p_{2}$}}
\end{picture}](img107.png)
Рис. 4
3.10. Идеальный газ расширяется
в процессе
![]() с линейной зависимостью давления от объема
(рис. 4). При этом его объем увеличивается в 2,5 раза, а температура в
состоянии 2 принимает то же значение, что и в состоянии 1. Затем газ
сжимают при постоянном давлении в процессе
с линейной зависимостью давления от объема
(рис. 4). При этом его объем увеличивается в 2,5 раза, а температура в
состоянии 2 принимает то же значение, что и в состоянии 1. Затем газ
сжимают при постоянном давлении в процессе
![]() до
первоначального объема. Найти отношение тепла, поглощенного в процессе
до
первоначального объема. Найти отношение тепла, поглощенного в процессе
![]() , к теплу, выделенному в процессе
, к теплу, выделенному в процессе
![]() . Молярная
теплоемкость газа
. Молярная
теплоемкость газа
![]() .
.
3.11.
Доказать, что адиабатический процесс в идеальном газе описывается уравнением:
3.12. Процесс, в течение которого теплоемкость системы остается постоянной, называется политропическим. Найти уравнение политропического процесса для идеального газа. Проанализировать частные случаи.