Исследование спектра излучения атомарного газа и паров различных веществ показывает, что он состоит из набора дискретных линий различной интенсивности, соответствующих различным длинам волн. Каждое вещество имеет свой присущий только ему набор длин волн -- спектр.
Спектры атомов различных веществ чрезвычайно разнообразны, некоторые вещества, например, железо, насчитывает около тысячи линий.
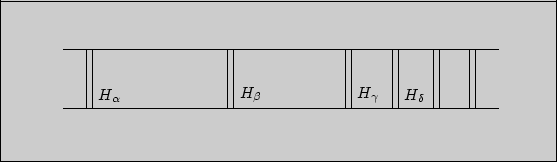
Наиболее простым является спектр атома водорода. В видимой области он состоит из четырех линий (рис. 1.1).

Рис. 1.1
Из спектрограммы видно, что линии спектра располагаются не беспорядочно,
а в определенном порядке -- подчиняются некоторой закономерности.
Изучая расположение линий в спектре атомарного водорода,
Бальмер в 1885 г. дал эмпирическую формулу, которая связывает длины волн этих линий,
![]() -- длина волны каждой из четырех линий водорода может быть получена
из соотношения:
-- длина волны каждой из четырех линий водорода может быть получена
из соотношения:

Если ввести вместо ![]() частоту
частоту ![]() , то формула Бальмера примет вид:
, то формула Бальмера примет вид:
В практической спектроскопии ![]() -- частоту заменяют величиной
-- частоту заменяют величиной
![]() , которая называется волновым числом. Волновое число
показывает, сколько длин волн укладывается в единицу длины. Таким образом,
серия водорода описывается соотношением:
, которая называется волновым числом. Волновое число
показывает, сколько длин волн укладывается в единицу длины. Таким образом,
серия водорода описывается соотношением:

Излучение водорода в ультрафиолетовой части спектра и инфракрасной подчиняется аналогичным закономерностям.
Серия Лаймана в дальней ультрафиолетовой части спектра:
Серия Пашена в инфракрасной области спектра:
Следовательно, все линии водорода можно разделить на ряд серий, представленных общей формулой:
Число ![]() определяет серию,
определяет серию, ![]() -- отдельную линию в серии.
-- отдельную линию в серии.
При ![]() получим серию Лаймана, при
получим серию Лаймана, при ![]() -- серию Бальмера,
при
-- серию Бальмера,
при ![]() -- серию Пашена. Общим для всех серий является то, что любое
волновое число может быть получено как разность двух постоянных величин:
-- серию Пашена. Общим для всех серий является то, что любое
волновое число может быть получено как разность двух постоянных величин:
![]() и
и ![]() которые называются термами. Если ввести
обозначения:
которые называются термами. Если ввести
обозначения:
Излучение веществ связано с процессами, происходящими внутри атома. На основании теории Бора, процесс излучения можно представить следующим образом.
В обычных условиях атомы пара и газа не излучают и находятся
в невозбужденном состоянии. Электроны в атоме занимают положения,
соответствующие минимальному значению потенциальной энергии для
данных условий (находятся на орбитах более близких к ядру). Если атому
сообщить некоторую энергию, то электроны, поглотив ее, переходят
на более далекие орбиты. Такое состояние атома называется возбужденным.
В возбужденном состоянии атом находится около ![]() , после
чего возвращается в первоначальное состояние или другое, с меньшим
значением потенциальной энергии электронов, чем при возбужденном.
При этом излучается квант энергии, частота которого определяется из
соотношения:
, после
чего возвращается в первоначальное состояние или другое, с меньшим
значением потенциальной энергии электронов, чем при возбужденном.
При этом излучается квант энергии, частота которого определяется из
соотношения:
где ![]() и
и ![]() - энергия системы в первом и втором стационарных
состояниях.
- энергия системы в первом и втором стационарных
состояниях.
Если сравнить соотношение (3), полученное из сериальных формул, и (4), то ясно, что термы сериальных формул имеют определенный физический смысл. Они связаны с энергией стационарных состояний электронов в атоме:
где ![]() и
и ![]() - номера энергетических уровней.
- номера энергетических уровней.
Линии серии Бальмера получаются при переходе электронов с более далеких энергетических уровней на второй (рис. 1.2). Линии серии Пашена при переходе на третий уровень.
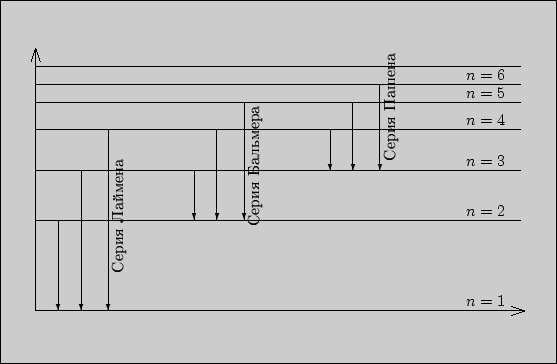
Рис. 1.2
Как уже отмечалось, чтобы атом излучал энергию, необходимо перевести его в возбужденное состояние. Возбуждение может быть вызвано соударением атомов друг с другом или с различными частицами: ионами, электронами. Такие процессы происходят в газоразрядных трубках. Если трубку наполнить разряженным газом и поместить в электростатическое поле высокого напряжения, то газ начинает светиться. Кинетическая энергия налетающей частицы превращается в потенциальную энергию возбужденного атома.
В нашей работе надо определить ![]() - постоянную Ридберга. Это одна из
важнейших констант. Она позволяет рассчитать энергию электрона в атоме водорода из соотношения:
- постоянную Ридберга. Это одна из
важнейших констант. Она позволяет рассчитать энергию электрона в атоме водорода из соотношения:
Для определения ![]() из серии Бальмера надо знать длины волны
видимой части спектра водорода. Для этого используют монохроматор УМ-2.
из серии Бальмера надо знать длины волны
видимой части спектра водорода. Для этого используют монохроматор УМ-2.