Пример 1.1. Сжиженные газы хранят в сосудах,
сообщающихся с атмосферой. Можно ли
допустить испарение жидкого азота объемом ![]() и
плотностью
и
плотностью
![]() в
закрытом сосуде объемом
в
закрытом сосуде объемом ![]() при нагревании
его до температуры
при нагревании
его до температуры ![]() , если стенки сосуда
выдерживают давление
, если стенки сосуда
выдерживают давление
![]() ?
?
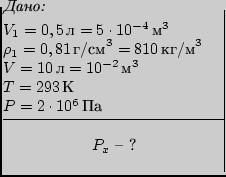 Решение.
При повышении температуры жидкий азот перейдет в газообразное
состояние.
Примем его при температуре
Решение.
При повышении температуры жидкий азот перейдет в газообразное
состояние.
Примем его при температуре ![]() за идеальный газ и
применим для решения
уравнение Клапейрона - Менделеева:
за идеальный газ и
применим для решения
уравнение Клапейрона - Менделеева:
где ![]() ,
, ![]() и
и ![]() - давление, объем и
температура газа;
- давление, объем и
температура газа; ![]() - его масса,
- его масса, ![]() - масса
моля азота, равная
- масса
моля азота, равная ![]() ;
; ![]() - универсальная
газовая постоянная.
- универсальная
газовая постоянная.
Для ответа на вопрос задачи нужно определить давление газообразного азота и сравнить его с максимально допустимым.
Выразим искомое давление из уравнения 1:
здесь неизвестна масса газа, ее можно определить через объем и
плотность жидкого азота:
![]() . Выражение для искомого давления в общем виде:
. Выражение для искомого давления в общем виде:
Проверка наименования единицы искомой величины:
Это единица давления в СИ, следовательно, выражение в общем виде получено правильно.
Вычисления: подставим числа (все они должны быть выражены в
СИ):
Прежде чем вычислять, проведем действия со степенями:
Искомое давление равно ![]() или
или ![]() и превышает
допустимое.
и превышает
допустимое.
Ответ: испарение жидкого азота данной массы в закрытом сосуде
указанного объема нельзя
допустить, так как при ![]() давление превысит
допустимое. Поэтому сжиженные газы хранят
в открытых сосудах.
давление превысит
допустимое. Поэтому сжиженные газы хранят
в открытых сосудах.
Пример 1.2. Цилиндрическая трубка длиной ![]() наполовину погружена в ртуть. Закрыв ее сверху,
трубку вынимают, при этом часть ртути выливается. Какой длины столбик
ртути останется в трубке,
если атмосферное давление равно
наполовину погружена в ртуть. Закрыв ее сверху,
трубку вынимают, при этом часть ртути выливается. Какой длины столбик
ртути останется в трубке,
если атмосферное давление равно ![]() мм рт. ст.?
мм рт. ст.?
 Решение.
Примем воздух, находящийся в трубке над ртутью, за идеальный газ.
Поскольку в условии задачи
изменение температуры не оговорено, к столбику воздуха можно применить
закон Бойля - Мариотта:
Решение.
Примем воздух, находящийся в трубке над ртутью, за идеальный газ.
Поскольку в условии задачи
изменение температуры не оговорено, к столбику воздуха можно применить
закон Бойля - Мариотта:
где ![]() и
и ![]() -- давление и объем
воздуха в первом состоянии;
-- давление и объем
воздуха в первом состоянии; ![]() и
и ![]() -- то же во
втором состоянии.
-- то же во
втором состоянии.
Для ответа на вопрос задачи нужно выразить параметры газа через
известные в общем виде
величины - ![]() и
и ![]() . Обозначим искомую
длину столбика ртути через
. Обозначим искомую
длину столбика ртути через ![]() . В первом
состоянии столбик воздуха длиной
. В первом
состоянии столбик воздуха длиной ![]() , то есть объемом
, то есть объемом
![]() (
(![]() - площадь
сечения трубки), находился под атмосферным давлением, так как трубка
была открыта сверху.
Выразим атмосферное давление:
- площадь
сечения трубки), находился под атмосферным давлением, так как трубка
была открыта сверху.
Выразим атмосферное давление: ![]() ,
где
,
где ![]() - плотность ртути. Таким образом,
- плотность ртути. Таким образом,
Во втором состоянии длина столбика воздуха стала равной ![]() , а его объем
, а его объем ![]() .
Давление воздуха в сумме с давлением оставшегося столбика ртути высотой
.
Давление воздуха в сумме с давлением оставшегося столбика ртути высотой
![]() уравновешивается
атмосферным давлением, действующим согласно закону Паскаля на нижний
открытый конец трубки:
уравновешивается
атмосферным давлением, действующим согласно закону Паскаля на нижний
открытый конец трубки:
![]() , откуда давление
, откуда давление
Подставив выражения (5 и 6)
в исходное уравнение (4) и
сократив на ![]() , получим квадратное уравнение
относительно
, получим квадратное уравнение
относительно ![]() :
:
Два корня этого уравнения:
Математическая часть задачи выполнена: найдены корни квадратного
уравнения. Однако
условию физической задачи корень уравнения со знаком "+" не
удовлетворяет, так как длина
столбика ртути в этом случае превышает длину трубки ![]() . Поэтому
. Поэтому
![]() . Видно, что
. Видно, что ![]() получится в единицах длины.
В числовом варианте решения подобной задачи
получится в единицах длины.
В числовом варианте решения подобной задачи ![]() и
и ![]() нужно подставлять в одинаковых
единицах длины, например, в м.
нужно подставлять в одинаковых
единицах длины, например, в м.
Ответ: искомая длина столбика выражается так:
Пример 1.3. В стеклянном сферическом сосуде с
внутренним диаметром ![]() находится азот,
давление которого при температуре
находится азот,
давление которого при температуре ![]() равно 1,33 Па. На стенках внутри сосуда имеется
мономолекулярный (толщиной в одну молекулу) слой адсорбированного, то
есть поглощенного
поверхностным слоем, азота. Одна молекула занимает площадь
равно 1,33 Па. На стенках внутри сосуда имеется
мономолекулярный (толщиной в одну молекулу) слой адсорбированного, то
есть поглощенного
поверхностным слоем, азота. Одна молекула занимает площадь
![]() . Найти
давление азота в сосуде при температуре
. Найти
давление азота в сосуде при температуре ![]() ,
при которой он полностью десорбируется
со стенок.
,
при которой он полностью десорбируется
со стенок.
 Решение.
Азот при таком низком давлении можно рассматривать как идеальный газ и
применить соответствующую теорию.
Искомое давление
Решение.
Азот при таком низком давлении можно рассматривать как идеальный газ и
применить соответствующую теорию.
Искомое давление ![]() будет складываться из давления
газа, первоначально находившегося
в сосуде
будет складываться из давления
газа, первоначально находившегося
в сосуде ![]() , и давления
, и давления ![]() , которое создадут
молекулы, перешедшие со стенок
в cocуд при температуре
, которое создадут
молекулы, перешедшие со стенок
в cocуд при температуре ![]() :
:
Выразим давление ![]() , учитывая, что повышение
температуры происходит при постоянном
объеме. Согласно закону Шарля:
, учитывая, что повышение
температуры происходит при постоянном
объеме. Согласно закону Шарля:
Видно, что единица измерения ![]() получается такая же,
как
получается такая же,
как ![]() - Па.
- Па.
Давление ![]() выразим из основного уравнения
кинетической теории идеального газа:
выразим из основного уравнения
кинетической теории идеального газа:
где ![]() - общее число десорбированных молекул,
- общее число десорбированных молекул, ![]() - их концентрация,
- их концентрация,
![]() - постоянная Больцмана,
- постоянная Больцмана, ![]() - объем сосуда:
- объем сосуда:
![]() .
Общее число молекул, перешедших со стенок в сосуд, можно выразить как
отношение
площади внутренней поверхности сферического сосуда
.
Общее число молекул, перешедших со стенок в сосуд, можно выразить как
отношение
площади внутренней поверхности сферического сосуда ![]() к площади одной молекулы:
к площади одной молекулы: ![]() . Окончательно для давления
. Окончательно для давления ![]() получим:
получим:
Проверка единиц измерения искомой величины:
Получена единица давления, то есть выражение в общем виде правильно.
Таким образом,
Вычисления:
Видно, что по порядку величины действие обоих факторов: роста давления с повышением температуры и увеличения концентрации молекул в сосуде -- согласуется по порядку величин. Второй фактор в данном случае оказывает большее действие.
Ответ: давление азота в сосуде станет равным 30,54 Па.
Пример 1.4. Найти среднее число всех парных
столкновений в секунду молекул кислорода,
находящихся в объеме ![]() при температуре
при температуре ![]() и давлении 666,5
Па.
и давлении 666,5
Па.
 Решение.
Согласно МКТ идеального газа среднее число столкновений в секунду одной
молекулы равно:
Решение.
Согласно МКТ идеального газа среднее число столкновений в секунду одной
молекулы равно:
Если учитывать только парные
столкновения, число всех столкновений в
секунду будет больше в ![]() раз, где
раз, где ![]() - общее
число молекул.
- общее
число молекул.
Тогда искомое число столкновений выразится так:
Далее следует выразить концентрацию газа из основного уравнения
кинетической теории
идеального газа: ![]() , а среднюю арифметическую скорость
-- через параметры газа:
, а среднюю арифметическую скорость
-- через параметры газа:
![]() , где
, где ![]() -- универсальная (молярная) газовая постоянная.
После подстановки для искомой величины получается:
-- универсальная (молярная) газовая постоянная.
После подстановки для искомой величины получается:
В этом выражении все, кроме диаметра молекулы, известно. Это число взято из таблицы.
Проверка единицы измерения искомой величины:
![\begin{displaymath}[\overline{Z}]={{м}^2\cdot{Н}^2\cdot{К}^2\cdot{м}^3\cdot{Дж}^...
... 2}\over{с}\cdot{м}^{3\over 2}\cdot{кг}^{1\over 2}}={с}^{-1}\,.\end{displaymath}](img116.png)
Наименование ![]() соответствует числу столкновений в
секунду.
соответствует числу столкновений в
секунду.
Вычисления:
Ответ: при указанных условиях происходит
![]() парных столкновений молекул
в секунду. Это число зависит от параметров состояния (
парных столкновений молекул
в секунду. Это число зависит от параметров состояния (![]() ), объема газа и его
индивидуальных характеристик: диаметра молекулы и молярной массы.
), объема газа и его
индивидуальных характеристик: диаметра молекулы и молярной массы.
Пример 1.5. Расстояние между стенками сосуда равно ![]() . При каком давлении вязкость
газа, находящегося между ними, начнет уменьшаться при откачке?
Температура газа равна
. При каком давлении вязкость
газа, находящегося между ними, начнет уменьшаться при откачке?
Температура газа равна
![]() . Диаметр молекулы составляет
. Диаметр молекулы составляет
![]() .
.
 Решение.
Теоретически вязкость газа при не слишком низких давлениях
не зависит от него:
Решение.
Теоретически вязкость газа при не слишком низких давлениях
не зависит от него:
так как ![]() - средняя длина свободного пробега молекул обратно
пропорциональна давлению при постоянной температуре:
- средняя длина свободного пробега молекул обратно
пропорциональна давлению при постоянной температуре:
а плотность газа ![]() прямо пропорциональна давлению.
Выражение для плотности идеального газа
можно получить из уравнения Клапейрона - Менделеева:
прямо пропорциональна давлению.
Выражение для плотности идеального газа
можно получить из уравнения Клапейрона - Менделеева:
![]() , учитывая,
что плотность -- это масса единицы объема:
, учитывая,
что плотность -- это масса единицы объема:
![]() . Получается, что
. Получается, что
![]() .
.
При низком давлении средняя длина свободного пробега перестает зависеть от давления и определяется размерами сосуда:
Молекулы движутся от стенки к стенке, не сталкиваясь между собой. Вязкость газа начнет уменьшаться при дальнейшей откачке сосуда за счет уменьшения концентрации молекул (плотности газа).
Для решения задачи нужно приравнять выражение для средней длины
свободного
пробeгa молекул ![]() расстоянию между стенками сосуда:
расстоянию между стенками сосуда:
В этом выражении для давления все известно.
Проверка наименования единицы измерения:
Выражение для давления в общем виде получено правильно.
Вычисления:
Полученное число значительно меньше величины атмосферного давления. Для
данного газа при неизменной
температуре оно определяется только размерами сосуда ![]() .
.
Ответ: при давлении 1,26 Па вязкость газа начнет уменьшаться
при откачке.
Указание: подобным образом решаются задачи, связанные с
коэффициентом теплопроводности
идеального газа:
Пример 1.6. 10 л азота, находящегося под давлением ![]() , расширяются вдвое.
Найти конечное давление и совершенную газом работу в случаях
изобарического,
изотермического и адиабатического процессов. Молекулы азота имеют пять
степеней свободы.
, расширяются вдвое.
Найти конечное давление и совершенную газом работу в случаях
изобарического,
изотермического и адиабатического процессов. Молекулы азота имеют пять
степеней свободы.
 Решение.
Примем азот в данных условиях за идеальный газ.
1. При изобарическом процессе давление газа не меняется, поэтому
Решение.
Примем азот в данных условиях за идеальный газ.
1. При изобарическом процессе давление газа не меняется, поэтому ![]() .
Элементарная работа расширения равна в общем случае
.
Элементарная работа расширения равна в общем случае ![]() , где
, где ![]() - давление,
- давление,
![]() - бесконечно малый объем. Полная работа находится путем
интегрирования, и величина
eе зависит от вида процесса.
- бесконечно малый объем. Полная работа находится путем
интегрирования, и величина
eе зависит от вида процесса.
При изобарическом процессе
Проверим единицу измерения работы:
2. В изотермическом процессе температура остается постоянной, а
давления и объемы в двух
состояниях идеального газа связаны законом Бойля - Мариотта: ![]() , откуда
, откуда
![]() . Видно, что здесь для единицы неизвестного давления
получается
Па (паскаль).
. Видно, что здесь для единицы неизвестного давления
получается
Па (паскаль).
Работа изотермического расширения рассчитывается так:
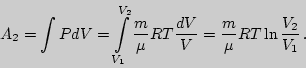
Результат не изменится, если подставить конечные давление и объем ![]() и
и
![]() или вместо отношения
или вместо отношения ![]() взять
взять ![]() .
.
3. Конечное давление адиабатического расширения выразим из уравнения
Пуассона:
Работа в этом процессе совершается за счет убыли внутренней энергии
газа:
В этой задаче температуры не заданы, поэтому отношение температур
следует заменить отношением
объемов
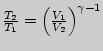 и воспользоваться
уравнением состояния идеального газа:
и воспользоваться
уравнением состояния идеального газа:
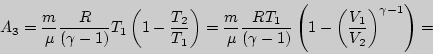
Здесь все известно, конечное давление можно рассчитать отдельно.
Вычисления:
![]()
![]()
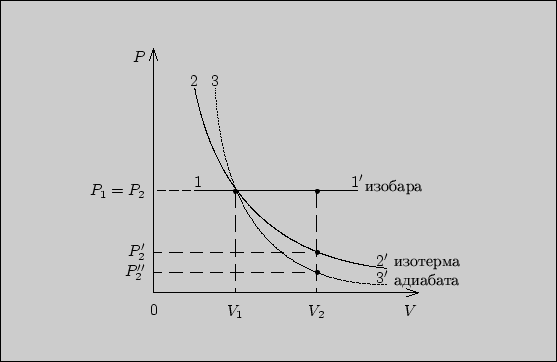
Таким образом, наибольшее изменение давления происходит при адиабатическом расширении, а наибольшая работа совершается при изобарическом. Качественно результаты представлены на рисунке. Площади фигур под графиками процессов позволяют судить о соотношении совершенной работы.
Ответ:
![]()
Пример 1.7. Холодильная машина, работающая по
обратному циклу Карно, передает теплоту от
холодильника с водой при температуре ![]() кипятильнику с водой при температуре
кипятильнику с водой при температуре ![]() C.
Какую массу воды нужно заморозить в холодильнике, чтобы превратить в
пар 1 кг воды в
кипятильнике? Удельная теплота парообразования воды при
C.
Какую массу воды нужно заморозить в холодильнике, чтобы превратить в
пар 1 кг воды в
кипятильнике? Удельная теплота парообразования воды при ![]() С равна
С равна
![]() . Удельная теплота плавления льда равна
. Удельная теплота плавления льда равна
![]() .
.
 Решение.
Холодильная машина за счет внешней работы отнимает некоторое количество
теплоты
Решение.
Холодильная машина за счет внешней работы отнимает некоторое количество
теплоты ![]() от менее нагретого тела при температуре
от менее нагретого тела при температуре ![]() и
передает теплоту
и
передает теплоту ![]() более нагретомy телу
при температуре
более нагретомy телу
при температуре ![]() .
Коэффициент полезного действия ее
.
Коэффициент полезного действия ее
![]() .
.
Такое же соотношение справедливо и для тепловой машины, совершающей работу за счет части теплоты, взятой у более нагретого тела.
Наибольший коэффициент полезного действия соответствует идеальному
(теоретическому) циклу Карно.
В этом случае
![]() , то есть кпд
определяется только
температурами нагревателя (тела при температуре
, то есть кпд
определяется только
температурами нагревателя (тела при температуре ![]() ) и
холодильника (
) и
холодильника (![]() ). С помощью
этого соотношения решается большинство задач, связанных с работой
тепловых и холодильных машин.
В реальных машинах кпд значительно меньше, чем
). С помощью
этого соотношения решается большинство задач, связанных с работой
тепловых и холодильных машин.
В реальных машинах кпд значительно меньше, чем
![]() .
.
В данной задаче количество теплоты ![]() , передаваемое более
нагретому телу, равно
, передаваемое более
нагретому телу, равно ![]() ,
а количество теплоты
,
а количество теплоты ![]() , взятое от менее нагретого тела,
равно
, взятое от менее нагретого тела,
равно ![]() , поэтому
справедливо равенство:
, поэтому
справедливо равенство:
Проверка наименования единицы:
Вычисления:
Ответ: чтобы испарить 1 кг воды в кипятильнике при заданных условиях, нужно заморозить 4,94 кг воды в холодильнике.