Сформулируем второе начало термодинамики в виде следующего утверждения (постулат Клаузиуса):
В природе не существует процесса, единственным результатом которого была бы передача тепла от тела с меньшей температурой к телу с большей температурой.
Результат процесса здесь понимается в самом широком смысле: изменения термодинамических параметров любых частей системы, совершение механической работы, изменение положения внешних тел, величин внешних сил и так далее. Постулат Клаузиуса, таким образом, означает, что невозможно осуществить такой процесс, в конце которого термодинамические параметры во всех частях системы приняли бы начальные значения (в частности, круговой процесс), не было бы совершено никакой механической работы (ни положительной, ни отрицательной), ничего не изменилось бы вне системы, но при этом произошла бы передача тепла от тела с меньшей температурой к телу с большей температурой. Такой процесс был бы эквивалентен самопроизвольному переходу тепла от холодного тела к горячему в изолированной системе (все сопутствующие процессы между началом и окончанием теплообмена в сумме компенсируются или вообще не происходят), что, как мы знаем из повседневного опыта, действительно невозможно.
Для дальнейших рассуждений нам необходимо ввести понятие цикла Карно - кругового
процесса, в котором система (рабочее тело) осуществляет теплообмен с двумя тепловыми
резервуарами (термостатами) с постоянной температурой.
Иными словами, процессы
поглощения и выделения тепла являются изотермическими, а процессы перехода от
взаимодействия с одним термостатом к взаимодействию с другим термостатом и
обратно - адиабатическими. При этом мы не устанавливаем никаких ограничений в
отношении количеств поглощенного и выделенного тепла, а также в отношении вещества, из
которого состоит рабочее тело (это может быть идеальный газ, вода, находящаяся в равновесии
с насыщенным паром, или любая другая термодинамическая система). Ограничимся пока
рассмотрением обратимого цикла Карно.
Тепло, поглощаемое от теплового резервуара с температурой ![]() , обозначим
, обозначим ![]() ;
тепло, отдаваемое резервуару с температурой
;
тепло, отдаваемое резервуару с температурой
![]() , обозначим
, обозначим ![]() (по
абсолютной величине). Работа, совершаемая за цикл, в соответствии с первым началом
термодинамики равна
(по
абсолютной величине). Работа, совершаемая за цикл, в соответствии с первым началом
термодинамики равна
В обратном цикле тепло ![]() будет поглощаться от холодного резервуара
будет поглощаться от холодного резервуара ![]() , а
горячему резервуару
, а
горячему резервуару ![]() будет отдаваться тепло
будет отдаваться тепло ![]() (по
абсолютной величине), что возможно при совершении
над системой внешней работы
(по
абсолютной величине), что возможно при совершении
над системой внешней работы
Докажем, используя постулат Клаузиуса, что для обратимого цикла Карно
имеет место следующее равенство:
Вначале докажем, что отношение ![]() не зависит от
термодинамических свойств рабочего тела (идеальный газ, реальный газ, жидкость и так
далее).
не зависит от
термодинамических свойств рабочего тела (идеальный газ, реальный газ, жидкость и так
далее).
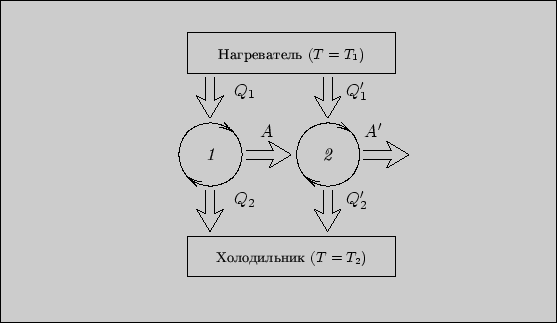
Рис. 6
Рассмотрим следующий процесс. Между
двумя тепловыми резервуарами с температурами ![]() и
и
![]() осуществляются два обратимых цикла Карно
осуществляются два обратимых цикла Карно
(рис. 6). В одном
из циклов при температуре ![]() поглощается тепло
поглощается тепло ![]() , а при температуре
, а при температуре ![]() выделяется тепло
выделяется тепло ![]() . За счет этого совершается работа
. За счет этого совершается работа ![]() . В другом
цикле поглощается тепло
. В другом
цикле поглощается тепло ![]() , выделяется тепло
, выделяется тепло ![]() и совершается
работа
и совершается
работа
![]() . Пусть рабочие тела циклов состоят из
различных веществ. Предположим, что вследствие этого отношения
. Пусть рабочие тела циклов состоят из
различных веществ. Предположим, что вследствие этого отношения ![]() и
и
![]() не равны друг другу, например,
не равны друг другу, например,
Выберем параметры циклов таким образом, чтобы работа ![]() была равна работе
была равна работе ![]() (очевидно, что это всегда возможно). Тогда, в соответствии с первым началом
термодинамики,
(очевидно, что это всегда возможно). Тогда, в соответствии с первым началом
термодинамики,
Поскольку по условию оба цикла обратимы, любой из них можно провести в противоположном
направлении. Представим, что мы проделали это со вторым циклом, то есть тепло ![]() будет теперь поглощаться от холодного резервуара, тепло
будет теперь поглощаться от холодного резервуара, тепло ![]() - передаваться
горячему резервуару. В этом случае вся работа,
произведенная в первом цикле, будет потрачена на осуществление второго цикла.
Тогда, согласно (6) и (7), получаем
- передаваться
горячему резервуару. В этом случае вся работа,
произведенная в первом цикле, будет потрачена на осуществление второго цикла.
Тогда, согласно (6) и (7), получаем
Выбор двух циклов с одинаковыми значениями работы нисколько не ограничивает общности нашего
доказательства. В том случае, если работы ![]() и
и ![]() не равны, но их отношение
равно отношению целых чисел
не равны, но их отношение
равно отношению целых чисел ![]() и
и ![]() , мы можем каждый из циклов провести соответствующее
количество раз, так, чтобы
, мы можем каждый из циклов провести соответствующее
количество раз, так, чтобы
![]() , тогда в наших рассуждениях
, тогда в наших рассуждениях ![]() и
и
![]() увеличатся в
увеличатся в ![]() раз, а
раз, а ![]() и
и ![]() - в
- в ![]() раз. При этом отношения
порций выделенного и поглощенного тепла в каждом из циклов не изменятся. Если же нельзя
подобрать таких конечных целых чисел
раз. При этом отношения
порций выделенного и поглощенного тепла в каждом из циклов не изменятся. Если же нельзя
подобрать таких конечных целых чисел ![]() и
и ![]() , чтобы
, чтобы
Все это означает, в частности, что для обратимых циклов Карно ![]() не зависит не только
от вещества, из которого состоит рабочее тело, но и от протяженности процессов
теплообмена. Действительно, предыдущее замечание, относящееся к случаю
не зависит не только
от вещества, из которого состоит рабочее тело, но и от протяженности процессов
теплообмена. Действительно, предыдущее замечание, относящееся к случаю
![]() , в равной мере справедливо для циклов с различным и одинаковым рабочим
веществом, а в случае двух циклов с одинаковым рабочим веществом неравенство работ как
раз и означает различие протяженностей изотермических участков (степеней сжатия).
Отношение выделенного тепла к поглощенному при этом, как мы видели, одно и то же.
, в равной мере справедливо для циклов с различным и одинаковым рабочим
веществом, а в случае двух циклов с одинаковым рабочим веществом неравенство работ как
раз и означает различие протяженностей изотермических участков (степеней сжатия).
Отношение выделенного тепла к поглощенному при этом, как мы видели, одно и то же.
Таким образом, можно сделать окончательный вывод о том, что отношение абсолютных
величин выделенного и поглощенного тепла в идеальном цикле Карно
зависит только от абсолютных температур термостатов.
Последнее обстоятельство позволяет нам провести вычисление отношения ![]() для
любого конкретного вещества, например, для идеального газа. Согласно
(8) мы получим при этом заведомо общий результат.
для
любого конкретного вещества, например, для идеального газа. Согласно
(8) мы получим при этом заведомо общий результат.
Цикл Карно для идеального газа изображен на рис. 7. Известно, что
внутренняя энергия идеального газа однозначно определяется его
температурой3. Поэтому на изотермических участках
![]() и
и
![]() внутренняя энергия не изменяется и, следовательно, на
участке
внутренняя энергия не изменяется и, следовательно, на
участке
![]() поглощенное тепло равно полезной работе, на участке
поглощенное тепло равно полезной работе, на участке
![]() выделенное тепло равно внешней работе:
выделенное тепло равно внешней работе: ![]() ,
,
![]() . Работу будем вычислять в соответствии с формулой (2) и
уравнением состояния идеального газа:
. Работу будем вычислять в соответствии с формулой (2) и
уравнением состояния идеального газа:
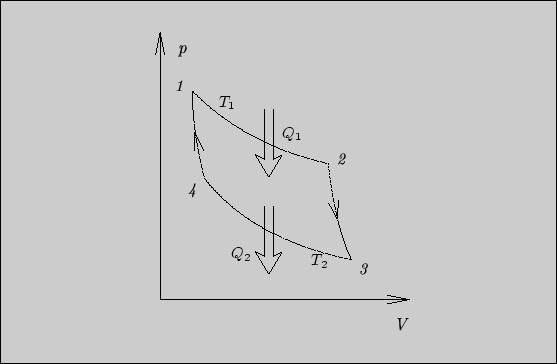
Рис. 7
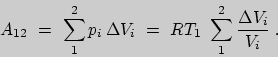
Домножим ![]() на произвольное положительное число
на произвольное положительное число ![]() . Это будет означать замену
. Это будет означать замену
![]() , причем сумма
, причем сумма
![]() при этом не
изменится:
при этом не
изменится:
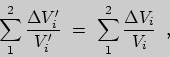
![\begin{picture}(69.00,61.00)
\emline{15.00}{13.00}{1}{15.00}{61.00}{2}
\emline{1...
...{33.00}{13.00}{316}
\put(11.00,59.00){\makebox(0,0)[rc]{${1/ V}$}}
\end{picture}](img169.png)
Рис. 8
Адиабатический процесс в идеальном газе описывается уравнением Пуассона