Вопросы и задачи к разделу 2
"Работа и теплота"
2.1.
Поглощенное телом тепло определяется как произведение его массы на
удельную теплоемкость и разность конечной и начальной температур:
Равновесие в теплоизолированной системе, состоящей из
нескольких тел, устанавливается в соответствии с уравнением теплового
баланса, которое выражает равенство количеств поглощенного и
выделенного разными телами тепла:
Для нашей системы уравнение теплового баланса имеет следующий вид7:
2.2.
Охлаждение воздуха внутри шарика происходит при постоянном
атмосферном давлении. Так как воздух при атмосферном давлении
близок по свойствам к идеальному газу, к нему можно применить
закон Гей-Люссака:
Работа, совершенная над шариком при постоянном давлении,
определяется как
Обратим внимание, что работа и тепло здесь измеряются в одинаковых единицах - джоулях. Причина этого выясняется в разделе 3.
Вопросы и задачи к разделу 3
"Первое начало термодинамики"
3.1.
В изобарном процессе часть поглощенного тепла расходуется на
совершение полезной работы, поэтому для увеличения температуры на
фиксированную величину требуется больше тепла, чем в изохорном
процессе, то есть теплоемкость ![]() всегда меньше теплоемкости
всегда меньше теплоемкости ![]() .
.
3.2.
Ответ на этот вопрос дан в разделе 8 на
странице [перейти]. Если температура газа изменяется в
изохорном процессе, то работа не совершается, и все поглощенное
(выделенное) тепло идет на увеличение (уменьшение) внутренней
энергии:
Далее заметим, что систему всегда можно перевести из
произвольного состояния 1 с температурой ![]() в другое
произвольное состояние 2 с температурой
в другое
произвольное состояние 2 с температурой ![]() путем
последовательного совершения изохорного и изотермического процесса (в
любой последовательности), а изотермические процессы не
изменяют значения внутренней энергии идеального газа. В
феноменологической термодинамике это свойство является
определением идеального газа, то есть идеальным, собственно, и
называется газ, обладающий данным свойством.
путем
последовательного совершения изохорного и изотермического процесса (в
любой последовательности), а изотермические процессы не
изменяют значения внутренней энергии идеального газа. В
феноменологической термодинамике это свойство является
определением идеального газа, то есть идеальным, собственно, и
называется газ, обладающий данным свойством.
С молекулярной точки зрения изотермическое изменение объема и давления идеального газа также не изменяет его внутреннюю энергию. Это ясно из следующих соображений. Во внутренюю энергию идеального газа дают вклад лишь кинетические энергии молекул, а они зависят только от температуры и не зависят от объема и давления8. Иными словами, поскольку взаимодействие на расстоянии между молекулами отсутствует, любой молекуле "безразлично", на каком расстоянии от нее находятся остальные молекулы, то есть какой объем занимает газ, в то же время ей "небезразлично", какими кинетическими энергиями обладают другие молекулы, то есть какова температура газа, так как кинетические энергии отдельных молекул в результате множества столкновений в среднем равны друг другу.
Таким образом, внутренняя энергия идеального газа является
однозначной функцией температуры; ее изменение при изменении
температуры от ![]() до
до ![]() равно
равно
3.3.
В обоих случаях в начальном состоянии объем газа - ![]() ,
давление -
,
давление - ![]() , следовательно, определена и температура газа -
, следовательно, определена и температура газа - ![]() .
Изотермическое расширение сопровождается поглощением тепла в
количестве, необходимом для поддержания постоянной температуры. В
процессе адиабатического расширения работа совершается только за
счет уменьшения внутренней энергии, следовательно, газ при этом
охлаждается.
.
Изотермическое расширение сопровождается поглощением тепла в
количестве, необходимом для поддержания постоянной температуры. В
процессе адиабатического расширения работа совершается только за
счет уменьшения внутренней энергии, следовательно, газ при этом
охлаждается.
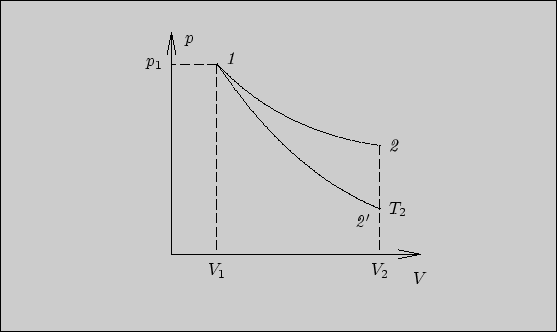
Рис. 23
Таким образом, в конечном состоянии приизотермическом расширении температура остается
прежней - ![]() , а в
случае адиабатического расширения становится меньше:
, а в
случае адиабатического расширения становится меньше: ![]() .
.
При одном и том же конечном объеме ![]() более
низкой температуре газа
будет соответствовать и меньшее значение давления, то есть
конечное давление будет больше при изотермическом расширении.
Другими словами, в точке пересечения изотермы и адиабаты на
диаграмме
более
низкой температуре газа
будет соответствовать и меньшее значение давления, то есть
конечное давление будет больше при изотермическом расширении.
Другими словами, в точке пересечения изотермы и адиабаты на
диаграмме ![]() изотерма изображается более пологой кривой
(рис. 23).
изотерма изображается более пологой кривой
(рис. 23).
3.4. Может, если совершаемая над газом внешняя работа
больше, чем прирост внутренней энергии:
Процессам с
отрицательной теплоемкостью на диаграмме ![]() соответствуют кривые,
наклон которых имеет промежуточное значение между наклоном изотермы и
адиабаты (см. рис. 23). Действительно, для изотермы
соответствуют кривые,
наклон которых имеет промежуточное значение между наклоном изотермы и
адиабаты (см. рис. 23). Действительно, для изотермы
![]() и
и
![]() 9, а для адиабаты
9, а для адиабаты ![]() и
и
![]() . Следовательно, в промежуточном случае для сжатия
. Следовательно, в промежуточном случае для сжатия
![]() и
и
![]() (в случае расширения
неравенства изменяются на противоположные и при охлаждении газа
происходит поглощение тепла).
(в случае расширения
неравенства изменяются на противоположные и при охлаждении газа
происходит поглощение тепла).
3.5.
Как уже отмечалось, при адиабатическом расширении газ
совершает работу за счет уменьшения внутренней энергии:
3.6. Описанный опыт является одним из вариантов известного опыта Джоуля по регистрации изменения температуры при расширении газов в пустоту в теплоизолирующей оболочке. В условиях поставленного вопроса теплоизоляция обеспечивается тем, что полость находится внутри сосуда с газом, то есть не имеет непосредственного теплового контакта с внешними телами, а также быстротой протекания процесса.
С точки зрения первого начала термодинамики при адиабатическом расширении идеального газа в пустоту сохраняется его внутренняя энергия и, следовательно, температура, так как отсутствует теплообмен с внешней средой и не совершается работа (из-за отсутствия внешних сил). Для реальных газов в описанном процессе внутренняя энергия и температура незначительно изменяются, так как увеличивается среднее расстояние между молекулами и при этом силами межмолекулярного взаимодействия совершается работа.
В опыте Джоуля проявлялись небольшие изменения температуры, причем для одних газов температура увеличивалась, а для других - уменьшалась. Чрезвычайно малая величина изменений температуры позволила Джоулю впервые ввести понятие идеального газа - такого газа, для которого при адиабатическом расширении в пустоту температура не изменяется (изменение пренебрежимо мало). Известное определение идеального газа с позиций молекулярной структуры было дано позднее.
3.7.
Рассмотрим изобарное расширение одного моля идеального газа
из состояния 1 в состояние 2. В данном процессе поглощается
количество тепла
Используя уравнение состояния идеального газа, выразим работу
через конечную и начальную температуры:
3.8.
Из уравнения состояния идеального газа
Из соотношения Майера для удельных теплоемкостей получаем
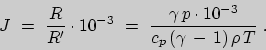
3.9.
Согласно первому началу термодинамики, изменение внутренней
энергии представляет собой разность между поглощенным теплом и
совершенной работой. Поглощенное тепло в нашем случае выражается
как
3.10.
По условию температуры в состояниях 1 и 2 равны, что для
идеального газа означает равенство внутренних энергий. Отсюда
следует, что поглощенное в процессе
![]() тепло равно
совершенной работе:
тепло равно
совершенной работе:
3.11.
Пусть величины давления и объема получают в адиабатическом процессе
малые приращения:
![]() ,
,
![]() , тогда, в соответствии с уравнением Пуассона,
, тогда, в соответствии с уравнением Пуассона,
Получим теперь связь между ![]() ,
, ![]() ,
, ![]() и
и ![]() в адиабатическом
процессе, исходя из уравнения состояния идеального газа и первого начала
термодинамики. Все вычисления будем проводить для одного моля идеального газа.
в адиабатическом
процессе, исходя из уравнения состояния идеального газа и первого начала
термодинамики. Все вычисления будем проводить для одного моля идеального газа.
Из уравнения состояния имеем
В адиабатическом процессе внутренняя энергия уменьшается за счет совершенной работы:
Сравнивая последнее равенство с (21), можно видеть, что уравнение Пуассона
будет справедливо при
![]() . Его можно записать как в переменных
. Его можно записать как в переменных ![]() ,
так и в переменных
,
так и в переменных ![]() (с учетом уравнения состояния идеального газа):
(с учетом уравнения состояния идеального газа):
3.12.
В отличие от предыдущей задачи при выводе уравнения типа (21) из уравнения
состояния идеального газа и первого начала термодинамики здесь нужно учитывать изменение
внутренней энергии как за счет совершенной работы (уменьшение), так и за счет
поглощенного тепла (увеличение)
При ![]() (27) выполняется для
(27) выполняется для ![]() , а (28)
соответствует уравнению изобарного процесса:
, а (28)
соответствует уравнению изобарного процесса: ![]() .
.
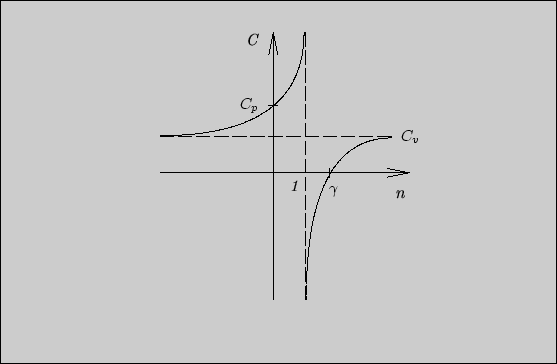
Рис. 24
Условие ![]() для (27)
означает
для (27)
означает ![]() и
и ![]() , а с точки зрения (28)
, а с точки зрения (28) ![]() означает
изотермический процесс:
означает
изотермический процесс: ![]() или
или ![]() . Изотермический процесс
действительно соответствует бесконечной теплоемкости (плюс бесконечность при расширении,
минус бесконечность - при сжатии).
. Изотермический процесс
действительно соответствует бесконечной теплоемкости (плюс бесконечность при расширении,
минус бесконечность - при сжатии).
При
![]() (
(![]() ) согласно (27)
) согласно (27) ![]() ,
а (28) можно переписать в виде
,
а (28) можно переписать в виде
![]() - изохорный
процесс.
- изохорный
процесс.
Наконец, при ![]() (28) переходит в уравнение адиабаты, а
(27) соответствует нулевому значению теплоемкости
(28) переходит в уравнение адиабаты, а
(27) соответствует нулевому значению теплоемкости ![]() .
.
Выразим из (27) теплоемкость ![]()
Этот, на первый взгляд, парадоксальный результат не
противоречит первому началу термодинамики. Снижение температуры при поглощении тепла
может быть обусловлено тем, что газ совершает работу, превышающую поглощенное тепло.
Наоборот, если при сжатии над газом производится работа, превышающая выделенное
тепло, то отдача тепла сопровождается нагреванием. Именно это и происходит в
политропических процессах с ![]() .
.
Вопросы и задачи к разделу 5
"Второе начало термодинамики"
5.1. В общем случае нельзя говорить о постоянстве внутренней энергии в обратимом изотермическом процессе, однако в частных случаях это возможно, если между внутренней энергией и температурой имеется взаимно однозначное соответствие, например, это справедливо для идеального газа (см. вопрос 3.2.).
В соответствии со вторым началом термодинамики для обратимых
процессов
Постоянство энтропии в обратимом адиабатическом процессе является прямым следствием второго начала термодинамики, поэтому имеет место в общем случае.
5.2.
В обратимом адиабатическом процессе
![]() .
Поэтому на диаграмме
.
Поэтому на диаграмме ![]() адиабата изображается отрезком
прямой, перпендикулярной оси
адиабата изображается отрезком
прямой, перпендикулярной оси ![]() , а цикл Карно, таким образом,
изображается прямоугольником (рис. 25).
, а цикл Карно, таким образом,
изображается прямоугольником (рис. 25).
![\begin{picture}(65.00,59.00)
\emline{10.00}{10.00}{1}{10.00}{59.00}{2}
\emline{9...
...){\makebox(0,0)[ct]{$A$}}
\put(52.00,8.00){\makebox(0,0)[ct]{$B$}}
\end{picture}](img409.png)
Рис. 25
Для тепловой машины направления
процессов соответствуют обходу цикла по часовой стрелке, для холодильной машины -
против часовой стрелки. Сравнивая определения элементарной полезной работы
5.3. Если в начальном состоянии температуры газов различны, то процесс взаимной диффузии сопровождается необратимым теплообменом, который, как мы знаем, дает положительный вклад в энтропию системы. Поэтому рассмотрение вопроса достаточно ограничить случаем, когда начальные температуры газов одинаковы. Если газы считать идеальными, то при равенстве начальных температур их конечные состояния после достижения равновесия в системе в отсутствие химического взаимодействия будут такими же, как если бы каждый из газов расширялся в пустоту.
Действительно, парциальное давление каждого из газов в равновесии должно быть одинаковым по всему объему системы и по закону Дальтона для идеальных газов должно давать независимый вклад в суммарное давление смеси. Следовательно, в смеси химически не взаимодействующих идеальных газов каждая из компонент в равновесном состоянии ведет себя таким образом, как если бы другие компоненты отсутствовали.
Рассматривая энтропию смеси газов как сумму энтропий компонент, приходим к выводу, что, поскольку энтропия каждой из компонент в процессе диффузии увеличивается (так же, как и при расширении в пустоту), возрастает и суммарная энтропия.
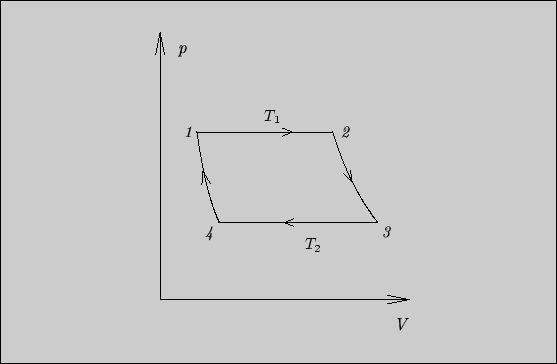
Рис. 26
Учет неидеальности газов может привести к небольшим поправкам в значениях конечных параметров, но не может качественно изменить результаты протекания процесса.
Рассмотренный процесс является одним из примеров необратимого процесса в замкнутой системе, поэтому второе начало термодинамики определенно указывает на возрастание энтропии в таком процессе. Однако мы провели рассмотрение вопроса, не пользуясь законом возрастания энтропии, так же, как делали это при обосновании данного закона.
5.4.
Такой цикл изображен на рис. 26. Изотермические участки одновременно
являются изобарными, так как давление насыщенного пара при заданной температуре
является фиксированной величиной. На изотерме
![]() происходит испарение.
Тепло, необходимое для парообразования, поглощается от теплового резервуара с
температурой
происходит испарение.
Тепло, необходимое для парообразования, поглощается от теплового резервуара с
температурой ![]() . На изотерме
. На изотерме
![]() происходит конденсация. Выделенное
тепло передается тепловому резервуару с температурой
происходит конденсация. Выделенное
тепло передается тепловому резервуару с температурой ![]() .
.
Чтобы замкнуть цикл, адиабатическое сжатие нужно начинать до того, как
вся испарившаяся вода сконденсируется изотермически (с выделением тепла в окружающую
среду). Следовательно, на участке адиабатического сжатия
![]() конденсация
пара продолжается, так как если всю воду, испарившуюся при расширении, сконденсировать на
участке
конденсация
пара продолжается, так как если всю воду, испарившуюся при расширении, сконденсировать на
участке
![]() , дальнейшее адиабатическое сжатие не приведет в состояние
, дальнейшее адиабатическое сжатие не приведет в состояние
![]() .
.
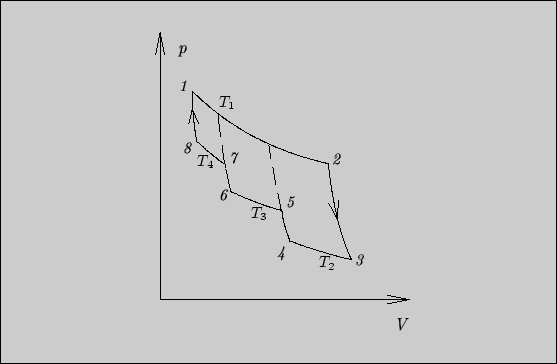
Рис. 27
При адиабатическом сжатии тепло, освободившееся в процессе конденсации, не выделяется в окружающую среду, а расходуется на увеличение внутренней энергии системы, складываясь с внешней работой.
В отношении участка адиабатического расширения можно сказать, что он
возможен без продолжения испарения, по крайней мере в том
случае, если в состоянии ![]() вся вода превратилась в пар.
вся вода превратилась в пар.
Таким образом, действительно, тепло, освободившееся при конденсации пара, больше, чем тепло, затраченное на испарение, но часть тепла конденсации не отдается в окружающую среду, а остается в системе.
5.5.
Продолжим адиабаты
![]() ,
,
![]() и
и
![]() до пересечения
с изотермой
до пересечения
с изотермой
![]() (см. рис. 27). Рассматриваемый цикл будет
эквивалентен последовательному прохождению трех циклов Карно, в каждом из которых
выделяется тепло
(см. рис. 27). Рассматриваемый цикл будет
эквивалентен последовательному прохождению трех циклов Карно, в каждом из которых
выделяется тепло ![]() , а поглощаются три различные порции тепла:
, а поглощаются три различные порции тепла:
Отношение выделенного тепла к поглощенному равно
Вопросы и задачи к разделу 6
"Первое и второе начала термодинамики в
теории тепловых машин"
6.1.
Пусть две адиабаты пересекаются на диаграмме ![]() (рис. 28). Если осуществить между состояниями 3 и 1
на этих адиабатах
изохорный процесс, как показано на рисунке, то получим цикл
(рис. 28). Если осуществить между состояниями 3 и 1
на этих адиабатах
изохорный процесс, как показано на рисунке, то получим цикл
![]() , в котором
совершается полезная работа,
численно равная площади криволинейного
треугольника 123. При этом
теплообмен происходит только на участке
, в котором
совершается полезная работа,
численно равная площади криволинейного
треугольника 123. При этом
теплообмен происходит только на участке
![\begin{picture}(66.00,59.00)
\emline{11.00}{10.00}{1}{11.00}{59.00}{2}
\emline{1...
...x(0,0)[rc]{{\it 3}}}
\put(54.00,18.00){\makebox(0,0)[rt]{{\it 2}}}
\end{picture}](img427.png)
Рис. 28
![]() , где тепло
поглощается. Таким образом, получаем вечный двигатель второго
рода, что противоречит второму началу термодинамики.
Следовательно, пересечение адиабат невозможно.
, где тепло
поглощается. Таким образом, получаем вечный двигатель второго
рода, что противоречит второму началу термодинамики.
Следовательно, пересечение адиабат невозможно.
Второй вариант ответа. Как мы уже знаем,
на диаграмме ![]() адиабаты
изображаются параллельными прямыми,
поэтому они не могут пересекаться. Отсутствие общих точек (общих
состояний) на двух
различных адиабатах позволяет заключить, что
они не могут пересекаться и на любых других диаграммах.
адиабаты
изображаются параллельными прямыми,
поэтому они не могут пересекаться. Отсутствие общих точек (общих
состояний) на двух
различных адиабатах позволяет заключить, что
они не могут пересекаться и на любых других диаграммах.
6.2.
Описанный рабочий цикл изображен на рис. 29.
По условию промежуточные состояния на участках
![]() и
и
![]() при двух вариантах прохождения цикла одинаковы,
значит, одинаковы и количества поглощенного и выделенного тепла. Таким образом,
остается выяснить, в каком случае поглощается больше тепла на
изотермическом участке цикла: при обратимом или необратимом
его прохождении. Начальное
состояние 1 и конечное состояние 2
изотермического участка для двух рассматриваемых случаев являются
общими, поэтому приращение энтропии
при двух вариантах прохождения цикла одинаковы,
значит, одинаковы и количества поглощенного и выделенного тепла. Таким образом,
остается выяснить, в каком случае поглощается больше тепла на
изотермическом участке цикла: при обратимом или необратимом
его прохождении. Начальное
состояние 1 и конечное состояние 2
изотермического участка для двух рассматриваемых случаев являются
общими, поэтому приращение энтропии ![]() одинаково для
обратимого и необратимого процессов. В
соответствии со вторым началом термодинамики для
обратимого изотермического
процесса выполняется равенство
одинаково для
обратимого и необратимого процессов. В
соответствии со вторым началом термодинамики для
обратимого изотермического
процесса выполняется равенство
![\begin{picture}(64.00,59.00)
\emline{9.00}{10.00}{1}{9.00}{59.00}{2}
\emline{8.0...
...x(0,0)[rc]{{\it 1}}}
\put(60.00,21.00){\makebox(0,0)[lc]{{\it 2}}}
\end{picture}](img429.png)
Рис. 29
Здесь возникает попутный вопрос: не приводит ли полученный
результат к тому, что к.п.д. необратимого цикла больше, чем
к.п.д. обратимого цикла с теми же промежуточными состояниями на
участках
![]() и
и
![]() ?
Действительно, работа (площадь контура
цикла на диаграмме
?
Действительно, работа (площадь контура
цикла на диаграмме ![]() одна и та же, а поглощенное тепло в
необратимом цикле меньше. На самом деле это, конечно, не так,
поскольку выражение для работы на элементарном участке
одна и та же, а поглощенное тепло в
необратимом цикле меньше. На самом деле это, конечно, не так,
поскольку выражение для работы на элементарном участке
6.3.
Как мы знаем, поглощенное тепло численно равно площади под
кривой процесса на диаграмме ![]() . Для данного цикла поглощенное
и выделенное тепло соответственно равны
. Для данного цикла поглощенное
и выделенное тепло соответственно равны
6.4.
В данном цикле тепло поглощается на изотермическом участке
![]() и выделяется на изохорном участке
и выделяется на изохорном участке
![]() . Максимальная температура достигается на
изотерме, а минимальная - в состоянии 3. Количество выделенного
тепла составляет
. Максимальная температура достигается на
изотерме, а минимальная - в состоянии 3. Количество выделенного
тепла составляет
6.5.
Работа, совершаемая в обратимом цикле, может быть выражена
через поглощенное
тепло следующим образом:
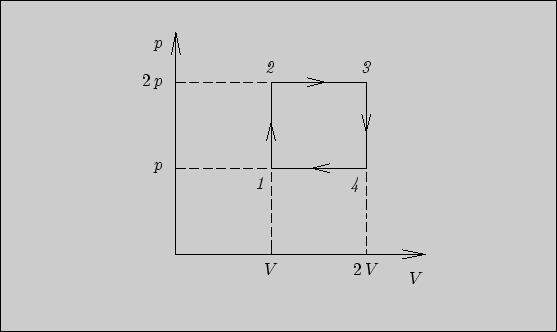
Рис. 30
Изобразим рассматриваемый
цикл на диаграмме ![]() (рис. 30).
Совершаемая в цикле работа равна
(рис. 30).
Совершаемая в цикле работа равна
а поглощенное тепло -
Подставляя значения температур в выражение
для ![]() , учитывая соотношение Майера и значение теплоемкости
, учитывая соотношение Майера и значение теплоемкости ![]() ,
получаем
,
получаем
К.п.д. цикла Карно с теми же предельными
температурами равен
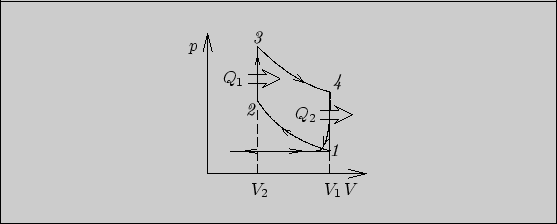
Рис. 31
6.6.
Цикл Отто (см. рис. 31) приближенно описывает работу карбюраторного
двигателя внутреннего сгорания.
Изобарный участок, примыкающий к состоянию 1, соответствует при
расширении - всасыванию горючей смеси, при сжатии - выхлопу
отработанных газов. После всасывания и сжатия рабочая смесь воспламеняется
искрой (состояние 2) и сгорает, выделяя тепло ![]() .
Процесс сгорания происходит достаточно быстро, поэтому приближенно
описывается изохорой
.
Процесс сгорания происходит достаточно быстро, поэтому приближенно
описывается изохорой ![]() . Участок
. Участок ![]() описывает
рабочий ход поршня после сгорания топлива. Участок
описывает
рабочий ход поршня после сгорания топлива. Участок ![]() в реальном двигателе
отсутствует. После открытия клапана в состоянии 4 давление выхлопных газов
быстро падает до атмосферного и происходит выхлоп. Этот процесс приближенно показан
кривой, начинающейся в состоянии 4. Однако после всасывания горючей смеси
система возвращается в состояние 1. Таким образом, реальный процесс
"выхлоп - всасывание" можно заменить изохорным охлаждением
в реальном двигателе
отсутствует. После открытия клапана в состоянии 4 давление выхлопных газов
быстро падает до атмосферного и происходит выхлоп. Этот процесс приближенно показан
кривой, начинающейся в состоянии 4. Однако после всасывания горючей смеси
система возвращается в состояние 1. Таким образом, реальный процесс
"выхлоп - всасывание" можно заменить изохорным охлаждением ![]() с выделением тепла
с выделением тепла ![]() .
.
Поглощенное тепло ![]() равно
равно
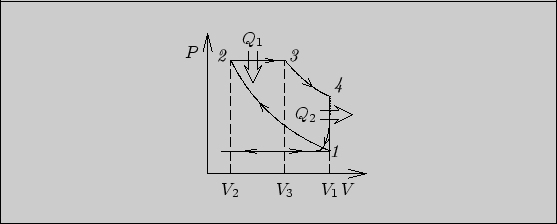
Рис. 32
Окончательно для к.п.д. цикла Отто находим
Повышение к.п.д. карбюраторного двигателя, согласно (29), возможно за счет
увеличения степени сжатия. Однако увеличение ![]() ограничено, так как при сильном
адиабатическом сжатии горючей смеси ее температура может повыситься
настолько, что самовозгорание произойдет до того, как поршень достигнет
положения, соответствующего минимальному объему газа в цилиндре.
ограничено, так как при сильном
адиабатическом сжатии горючей смеси ее температура может повыситься
настолько, что самовозгорание произойдет до того, как поршень достигнет
положения, соответствующего минимальному объему газа в цилиндре.
6.7.
На рис. 32 изображена диаграмма цикла Дизеля, приближенно
описывающая работу дизельного двигателя.
В цилиндр дизельного двигателя всасывается и подвергается адиабатическому
сжатию (![]() ) чистый воздух. Поэтому ограничение на степень
сжатия накладывается лишь прочностью цилиндра. В состоянии 2 в рабочий
объем из форсунки впрыскивается дизельное топливо, причем температура
воздуха в состоянии 2 оказывается достаточно высокой для
самовозгорания рабочей смеси.
Горение дизельного топлива считается
относительно медленным, так что поршень успевает смещаться и процесс горения
приближенно описывается изобарой
) чистый воздух. Поэтому ограничение на степень
сжатия накладывается лишь прочностью цилиндра. В состоянии 2 в рабочий
объем из форсунки впрыскивается дизельное топливо, причем температура
воздуха в состоянии 2 оказывается достаточно высокой для
самовозгорания рабочей смеси.
Горение дизельного топлива считается
относительно медленным, так что поршень успевает смещаться и процесс горения
приближенно описывается изобарой ![]() .
Адиабата
.
Адиабата ![]() и
изохора
и
изохора ![]() соответствуют рабочему ходу поршня и возврату в
начальное состояние с выделением тепла
соответствуют рабочему ходу поршня и возврату в
начальное состояние с выделением тепла ![]() (в отношении реального процесса
выхлопа справедливо то же, что сказано в решении предыдущей задачи).
(в отношении реального процесса
выхлопа справедливо то же, что сказано в решении предыдущей задачи).
Поглощенное в изобарном процессе тепло
Подставляя отношения температур в выражение для к.п.д., окончательно
получаем
К.п.д. двигателя Дизеля, в соответствии с (30), повышается при увеличении степени сжатия. Как уже говорилось, степень сжатия в дизельном двигателе может быть значительно больше, чем в карбюраторном двигателе, поскольку она не ограничена пределом самовозгорания рабочей смеси. Однако при увеличении степени сжатия повышается давление в цилиндре двигателя и, соответственно, требуется более прочный цилиндр. Поэтому, наращивая к.п.д. за счет увеличения степени сжатия, мы должны одновременно увеличивать прочность (и, следовательно, массу) двигателя.
Увеличить к.п.д. дизельного двигателя, согласно (30), можно также при
уменьшении степени предварительного расширения. Действительно, отношение
![]() уменьшается при снижении
уменьшается при снижении ![]() , что приводит к
увеличению к.п.д. Степень предварительного расширения будет уменьшаться при сокращении
порции топлива, впрыскиваемого в рабочий объем в каждом цикле. Однако при этом
уменьшается и мощность двигателя (сокращается площадь внутри контура цикла на диаграмме
(
, что приводит к
увеличению к.п.д. Степень предварительного расширения будет уменьшаться при сокращении
порции топлива, впрыскиваемого в рабочий объем в каждом цикле. Однако при этом
уменьшается и мощность двигателя (сокращается площадь внутри контура цикла на диаграмме
(![]() ) и, следовательно, уменьшается полезная работа в каждом цикле).
) и, следовательно, уменьшается полезная работа в каждом цикле).
Оптимальный
режим работы дизельного двигателя определяется компромиссом между увеличением к.п.д.
за счет повышения степени сжатия и нежелательным наращиванием массы двигателя, а также
между увеличением к.п.д. за счет снижения ![]() и одновременным снижением мощности.
и одновременным снижением мощности.
6.8.
Доказательство эквивалентности двух утверждений означает доказательство того, что из
первого утверждения следует второе, а из второго - первое. Заметим, что если
невыполнение утверждения ![]() неминуемо приводит к невыполнению утверждения
неминуемо приводит к невыполнению утверждения ![]() ,
то это означает, что из
,
то это означает, что из ![]() следует
следует ![]() , так как если бы
, так как если бы ![]() в этом случае
не следовало из
в этом случае
не следовало из ![]() , то его нарушение могло бы иметь место и при выполнении
, то его нарушение могло бы иметь место и при выполнении ![]() .
.
Докажем вначале эквивалентность принципа Томсона и принципа Клаузиуса. Пусть нарушен
принцип Клаузиуса. В этом случае возможен процесс, единственным результатом которого
была бы передача тепла от холодного тела к горячему. Рассмотрим процесс, в котором
тепло ![]() передается от теплового резервуара с температурой
передается от теплового резервуара с температурой ![]() к тепловому
резервуару с температурой
к тепловому
резервуару с температурой ![]() (
(![]() ) без других изменений в системе.
Проведем между этими термостатами
цикл Карно, в котором тепло
) без других изменений в системе.
Проведем между этими термостатами
цикл Карно, в котором тепло ![]() поглощается от горячего термостата, а холодному
отдается тепло
поглощается от горячего термостата, а холодному
отдается тепло ![]() . В результате последовательности этих двух процессов для
холодного резервуара сумма отданного и полученного тепла равна нулю, горячий резервуар
получает тепло
. В результате последовательности этих двух процессов для
холодного резервуара сумма отданного и полученного тепла равна нулю, горячий резервуар
получает тепло ![]() , а отдает
, а отдает ![]() , то есть в сумме отдает тепло
, то есть в сумме отдает тепло ![]() , которое,
в соответствии с первым началом термодинамики, идет на совершение равной ему работы
, которое,
в соответствии с первым началом термодинамики, идет на совершение равной ему работы
![]() . При этом никаких изменений в системе, кроме полного преобразования тепла
. При этом никаких изменений в системе, кроме полного преобразования тепла ![]() в
работу, не происходит.
Мы могли бы осуществлять этот процесс циклически, подобрав параметры цикла Карно
таким образом, чтобы передаваемое холодному резервуару тепло в каждый промежуток
времени в точности компенсировало тепло, самопроизвольно передаваемое от холодного
термостата к горячему. Это означает возможность построения вечного двигателя второго
рода, что противоречит принципу Томсона. Таким образом, принцип Клаузиуса является следствием
принципа Томсона.
в
работу, не происходит.
Мы могли бы осуществлять этот процесс циклически, подобрав параметры цикла Карно
таким образом, чтобы передаваемое холодному резервуару тепло в каждый промежуток
времени в точности компенсировало тепло, самопроизвольно передаваемое от холодного
термостата к горячему. Это означает возможность построения вечного двигателя второго
рода, что противоречит принципу Томсона. Таким образом, принцип Клаузиуса является следствием
принципа Томсона.
Пусть теперь нарушен принцип Томсона. Тогда возможна циклически действующая машина,
полностью преобразующая поглощенное тепло в работу. Возьмем машину, которая в каждом
цикле поглощает от термостата тепло ![]() и производит равную ему работу. Используем
эту работу в качестве внешней для обратного цикла Карно, в котором тепло
и производит равную ему работу. Используем
эту работу в качестве внешней для обратного цикла Карно, в котором тепло ![]() поглощается от другого, более холодного, термостата, а первому термостату отдается
тепло
поглощается от другого, более холодного, термостата, а первому термостату отдается
тепло ![]() . Легко понять, что суммарным результатом такого процесса будет
передача тепла
. Легко понять, что суммарным результатом такого процесса будет
передача тепла ![]() от холодного тела к горячему, причем результат этот будет
единственным, так как обе машины совершили полный цикл и вся произведенная первой
машиной работа затрачена на приведение в действие второй машины. Тем самым нарушен
принцип Клаузиуса. Это означает, что из принципа Клаузиуса следует принцип Томсона.
Эквивалентность этих двух формулировок второго начала термодинамики доказана.
от холодного тела к горячему, причем результат этот будет
единственным, так как обе машины совершили полный цикл и вся произведенная первой
машиной работа затрачена на приведение в действие второй машины. Тем самым нарушен
принцип Клаузиуса. Это означает, что из принципа Клаузиуса следует принцип Томсона.
Эквивалентность этих двух формулировок второго начала термодинамики доказана.
![\begin{picture}(65.00,39.00)
\put(18.00,34.00){\makebox(0,0)[cb]{Принцип}}
\put(...
...{47}{43.00}{27.00}{48}
\emline{43.00}{27.00}{49}{44.44}{24.00}{50}
\end{picture}](img481.png)
Рис. 33
В разделе 5.3 мы получили принцип энтропии как прямое следствие постулата
Клаузиуса. Далее было доказано (см. раздел 6, с. [перейти]), что
принцип
Томсона следует из принципа энтропии. Доказав эквивалентность принципов
Клаузиуса и Томсона, мы можем представить наши результаты в виде схемы (см.
рис. 33). Двигаясь на схеме по стрелкам, указывающим
направления логических следствий, мы можем от любого из принципов прийти к любому
другому, что и означает их эквивалентность.
Вопросы и задачи к разделу 7
"Холодильные машины"
7.1. При более высокой температуре в помещении холодильник потребляет больше электроэнергии по двум причинам.
Первая из них
связана с тем, что выброс избытка энтропии в окружающую среду при
более высокой температуре требует выделения большего количества
тепла. Поэтому для извлечения фиксированного количества тепла из
морозильной камеры требуется большая внешняя работа
Вторая причина связана с тем, что при более высокой температуре окружающего воздуха интенсивнее идет процесс просачивания тепла внутрь холодильника, и для поддержания фиксированной температуры в морозильной камере (а именно на этот показатель настраивается работа реле, включающего и выключающего компрессор) требуется большая продолжительность работы компрессора по отношению ко времени остановки.
Поясним сказанное количественно, считая, что в холодильной
машине реализуется обратимый цикл Карно. Тогда если температура
в помещении - ![]() , а температура в морозильной камере -
, а температура в морозильной камере - ![]() , то
, то
7.2.
Тепло, поглощаемое рабочим телом холодильной машины при
замерзании воды в морозильной камере, равно
Вопросы и задачи к разделу 8
"Замечательные задачи"
8.1.
Объем вытесненного телом воздуха (
![]() ) ничтожно
мал по сравнению с объемом воздуха в комнате (
) ничтожно
мал по сравнению с объемом воздуха в комнате (
![]() ),
поэтому мы пренебрежем уменьшением объема и массы воздуха в
комнате в результате внесения тела.
),
поэтому мы пренебрежем уменьшением объема и массы воздуха в
комнате в результате внесения тела.
Температуру ![]() , установившуюся в результате теплообмена
между воздухом в комнате и телом, можно определить из уравнения
теплового баланса:
, установившуюся в результате теплообмена
между воздухом в комнате и телом, можно определить из уравнения
теплового баланса:
Мы знаем, что при постоянном атмосферном давлении произведение
массы воздуха в комнате на его температуру - величина постоянная.
Поэтому при охлаждении воздуха в комнате будет увеличиваться его
масса за счет притока воздуха из внешней среды. Строго говоря,
это обстоятельство нужно было бы учесть в уравнении теплового
баланса, что привело бы к появлению дополнительного слагаемого в
левой части уравнения, соответствующего тепловому вкладу пришедшего
извне воздуха (это можно сделать, если дополнительно задать
температуру наружного воздуха). Однако реально, как можно
предположить (и мы в этом убедимся), температура воздуха и,
следовательно, его масса изменяются незначительно. Поэтому для
вычисления ![]() воспользуемся уже записанным уравнением:
воспользуемся уже записанным уравнением:
Таким образом, температура воздуха в комнате уменьшается примерно
на ![]() , а температура тела увеличивается на
, а температура тела увеличивается на ![]() .
Поскольку работы в процессе нагрева тела не совершается, все
переданное ему тепло идет на увеличение его внутренней энергии:
.
Поскольку работы в процессе нагрева тела не совершается, все
переданное ему тепло идет на увеличение его внутренней энергии:
Из постоянства произведения массы воздуха в
комнате на его температуру имеем
Если температура наружного воздуха отличается от ![]() , то
результат изменяется несущественно, так как отличие температуры
окружающей среды от
, то
результат изменяется несущественно, так как отличие температуры
окружающей среды от ![]() в реальной ситуации все равно
намного меньше, чем сама величина
в реальной ситуации все равно
намного меньше, чем сама величина ![]() . Однако следует
заметить, что и в этом случае при внесении соответствующего
уточнения в уравнение теплового баланса окажется, что прирост
внутренней энергии тела в точности покрывается за счет внешней
работы и внутренней энергии пришедшего извне воздуха.
. Однако следует
заметить, что и в этом случае при внесении соответствующего
уточнения в уравнение теплового баланса окажется, что прирост
внутренней энергии тела в точности покрывается за счет внешней
работы и внутренней энергии пришедшего извне воздуха.
8.2.
Температура воды в отопительной системе поддерживается
постоянной за счет того, что тепло, отдаваемое отапливаемому
помещению, компенсируется теплом, поступающим в отопительную
систему из высокотемпературного и низкотемпературного
(природного) тепловых резервуаров. Таким образом, при неизменных
условиях в отапливаемом помещении постоянным должно оставаться
и тепло, поступающее в отопительную систему. Для динамической
системы отопления это тепло, как мы знаем, выражается формулой
(20):
Аналогично выражается масса топлива ![]() при новой температуре
природного резервуара
при новой температуре
природного резервуара
![]() (значения остальных величин при
этом остаются прежними). Тогда отношение масс равно
(значения остальных величин при
этом остаются прежними). Тогда отношение масс равно
Таким образом, при повышении температуры природного резервуара с
![]() до
до ![]() потребление топлива для поддержания прежней
температуры в отопительной системе можно уменьшить в 1,32 раза.
потребление топлива для поддержания прежней
температуры в отопительной системе можно уменьшить в 1,32 раза.